Wie ein Pilz das Immunsystem von Pflanzen hemmt
27.10.2016Ein neu entdecktes Protein aus einem Pilz ist dazu in der Lage, das angeborene Immunsystem von Pflanzen zu unterdrücken. Das berichten Forschungsteams aus Köln und Würzburg im Fachblatt „Nature Communications“.
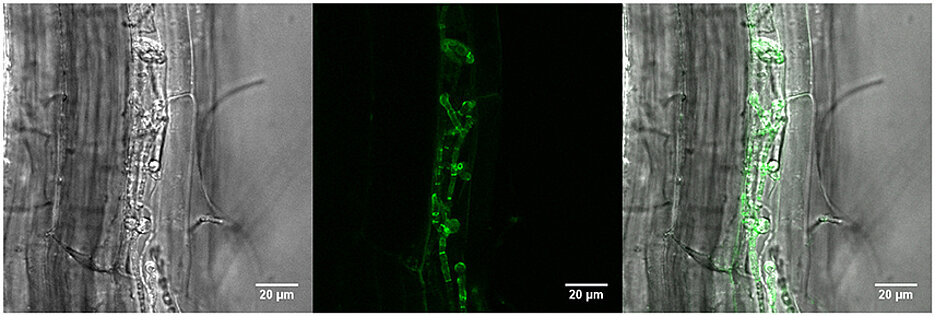
Der Pilz Piriformospora indica besiedelt die Wurzeln unterschiedlichster Pflanzen. Das können Orchideen, Tabak, Gerste oder sogar Moose sein. Dabei dringt er zwar in die Wurzeln ein, schädigt die Pflanzen damit aber nicht. Ganz im Gegenteil: Er kann das Wachstum seiner Pflanzenpartner sogar fördern. Solche und andere Wechselwirkungen, die zwischen dem Pilz und seinen Partnern ablaufen, sind der Wissenschaft bereits bekannt.
Über eine neue Facette der Pilz-Pflanze-Beziehung berichten jetzt Forschungsgruppen aus Köln und Würzburg in „Nature Communications“: Die Forscher identifizierten ein Protein, mit dem der Pilz die Immunabwehr der besiedelten Pflanzen unterdrückt. So sorgt er dafür, dass er nicht wie krankheitserregende Pilze attackiert wird und die Beziehung auf Dauer gelingen kann.
Das Protein „Fungal Glucan Binding 1“ (FGB1) bewirkt unter anderem, dass in der Pflanze der „oxidative burst“ unterbleibt. Dabei werden normalerweise aggressive Sauerstoffradikale erzeugt, die potenzielle Krankheitserreger zerstören und das Immunsystem der Pflanze aktivieren.
Protein macht die Pflanze blind für Pilzstrukturen
Wie legt das Protein die Immunabwehr der Pflanze lahm? „Es bindet sich hoch affin und sehr spezifisch an Zuckermoleküle, die in der Zellwand der Pilze sitzen und von der Pflanze normalerweise als ‚fremd‘ erkannt werden“, erklärt Molekularbiologie-Professorin Alga Zuccaro von der Universität zu Köln. FGB1 wirkt wie ein Tarnmantel und verbirgt die fremden Zuckermoleküle vor dem Immunsystem.
Bei den fraglichen Zuckermolekülen handle es sich um beta-1,3/1,6-Glucane, so Chemieprofessor Jürgen Seibel von der Universität Würzburg. Dass Pilz-Glucane das Immunsystem des Menschen in Schwung bringen, ist schon seit Längerem bekannt. Weniger bekannt ist, dass sie auch das Immunsystem der Pflanzen stimulieren können.
Dass aber im Fall von Piriformospora indica die Immunabwehr durch FGB1 unterdrückt wird, das konnten Zuccaro und Seibel nun durch die Kombination des Know-hows ihrer Arbeitsgruppen zeigen. Die Kölner Molekularbiologin ist Expertin für wurzelbesiedelnde Pilze und das pflanzliche Immunsystem, der Würzburger Chemiker ist Fachmann für Zuckermoleküle und deren Funktionen in Zellen und Organismen.
Perspektive für die medizinische Diagnostik
Die neuen Erkenntnisse lassen sich vielleicht in der Medizin und der Pflanzenzüchtung nutzen. Weil das neu entdeckte Protein FGB1 eine so hohe Affinität und Spezifität zu beta-1,6-Glucanen aus Pilzzellwänden hat, eignet es sich womöglich für die Diagnostik von Pilzinfektionen beim Menschen. Außerdem könnte das neue Wissen langfristig zur Züchtung von Pflanzen mit erhöhter Krankheitsresistenz beitragen.
Als nächstes soll untersucht werden, wie die Pflanzen die beta-1,3/1,6-Glucane erkennen und wie genau FGB1 dies unterdrückt.
The fungal-specific ß-glucan-binding lectin FGB1 alters cell-wall composition and suppresses glucan-triggered immunity in plants. Stephan Wawra, Philipp Fesel, Heidi Widmer, Malte Timm, Jürgen Seibel, Lisa Leson, Leona Kesseler, Robin Nostadt, Magdalena Hilbert, Gregor Langen & Alga Zuccaro, Nature Communications, 27.10.2016, DOI:10.1038/ncomms13188
Kontakt
Prof. Dr. Alga Zuccaro, Universität Köln, T (0221) 470-7170, azuccaro@uni-koeln.de
Prof. Dr. Jürgen Seibel, Universität Würzburg, T (0931) 31-85326, seibel@chemie.uni-wuerzburg.de