Würzburger Forschende enthüllen neue Funktion von Onkoproteinen
08.05.2024Forschende der Uni Würzburg haben herausgefunden: Das Onkoprotein MYCN lässt Krebszellen nicht nur stärker wachsen, sondern macht sie auch resistenter gegen Medikamente. Für die Entwicklung neuer Therapien ist das ein Durchbruch.

Eigentlich sind Onkoproteine für Menschen überlebenswichtig: Tausendfach sorgen sie in unseren Körpern dafür, dass Zellen wachsen und sich teilen. Sie unterstützen die Wundheilung, reparieren Schäden im Erbgut und stärken unser Immunsystem. Funktionieren Onkoproteine nicht mehr richtig, wird es jedoch schnell gefährlich – dann verursachen sie unkontrolliertes Zellwachstum und lassen Tumore entstehen. Das Onkoprotein MYCN beispielsweise gilt als Verursacher einer Vielzahl aggressiver Krebstypen und Tumore, unter denen vor allem Kinder leiden.
„MYCN-Proteine regulieren im Zellkern die Herstellung sogenannter Boten-RNA (mRNA) und damit die Produktion von Proteinen, die das Zellwachstum fördern“, erklärt Martin Eilers, Leiter des Lehrstuhls für Biochemie und Molekularbiologie an der Julius-Maximilians-Universität (JMU) Würzburg. „Gerät dieser Vorgang außer Kontrolle, kann das zu übermäßigem Wachstum führen, zur Entstehung von Mutationen und schließlich zu Krebs.“
Zweite, bislang unbekannte Funktion nachgewiesen
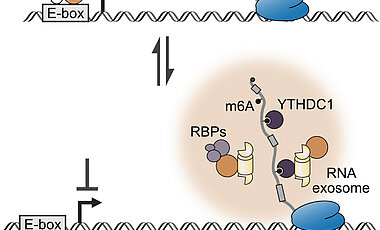
Gemeinsam mit seinem Team entdeckte Eilers nun aber noch eine zweite Funktion von MYCN – zusätzlich zur Regulierung der mRNA-Produktion: Ähnlich wie ein Gefahrensensor kann MCYN eine Krebszelle warnen, wenn es Probleme bei der Reifung von mRNA gibt. Das löst dann zellinterne Selbstschutzmechanismen aus, etwa die Aktivierung der Zellreparatur oder die Produktion schützender Moleküle. „MYCN ist also nicht nur verantwortlich für das schnelle Wachstum einer Krebszelle, sondern macht sie darüber hinaus auch noch resistenter gegen externe Stressoren – beispielsweise gegen die Medikamente, mit denen wir den Krebs heilen wollen“, so der Biochemiker.
Und so funktioniert’s: MYCN-Proteine binden sich, anders als bislang bekannt, auch direkt an mRNA und existieren in Zellen in DNA- oder mRNA-gebundener Form. Wird die Reifung der mRNA gestört, wechseln sie von der DNA- in die mRNA-gebundene Form. Dieser Wechsel löst dann den Zellschutz aus.
„Diese Erkenntnis stellt ein seit Jahrzehnten existierendes Modell für eine der wichtigsten Gruppen von Onkogenen in Frage“, weiß Dimitrios Papadopoulos, Postdoc in Eilers´ Team. „Mechanistisch erklärt sie viele biochemische Eigenschaften von MYCN, die bislang unverstanden waren. Zum Beispiel erklären sie die Rolle von Teilabschnitten des MYCN-Proteins, von denen man nur wusste, dass sie für die Funktion von MYCN wichtig sind, aber nicht weshalb.“
Grundlage für die Entwicklung neuer Medikamente
In mehreren nationalen und internationalen Kooperationen arbeitet Eilers Forschungsgruppe an der Entwicklung von Medikamenten, die MYCN angreifen können, indem sie in Krebszellen den Abbau dieser Proteine auslösen. Beteiligt sind etwa Forschende des Massachusetts Institute of Technology (MIT) und des Instituts für Molekulare Biologie Mainz. „Für die Suche nach diesen Medikamenten, den sogenannten PROTACs, ist es entscheidend, die Funktionsweise von MYCN genau zu kennen und zu verstehen, mit welchen Partnern das Protein wechselwirkt“, erklärt Papadopoulos. „PROTAC steht für ,Proteolyis targeting Chimera (Proteinabbau-induzierende Chimäre)´ und bezeichnet neuartige Medikamente, die gezielt den Abbau von Onkoproteinen auslösen können.“ „Im nächsten Schritt werden wir nun gezielt Medikamente entwickeln, die MYCN-mRNA-Komplexe angreifen – zudem wollen wir verstehen, was die genaue Funktion dieser Verbindungen ist.“
Finanziell unterstützt wurde die Forschung durch den Europäischen Forschungsrat und die Deutsche Krebshilfe.
Zur Studie
D. Papadopoulos, S. A. Ha, D. Fleischhauer, L. Uhl, T. J. Russell, I. Mikicic, K. Schneider, A. Brem, O. R. Valanju, G. Cossa, P. Gallant, C. Schuelein-Voelk, H. M. Maric, P. Beli, G. Buchel, S. M. Vos, and M. Eilers. 2024. 'The MYCN oncoprotein is an RNA-binding accessory factor of the nuclear exosome targeting complex', Mol Cell. DOI: 10.1016/j.molcel.2024.04.007
Kontakt
Prof. Dr. Martin Eilers, Leiter des Lehrstuhls für Biochemie und Molekularbiologie, Tel. +49 931 31-84111, martin.eilers@uni-wuerzburg.de