Wie DNA für die Zellteilung verpackt wird
03.06.2022Im Journal „Science“ präsentieren Forschungsgruppen aus Heidelberg und Würzburg das Innenleben der molekularen Maschinerie, die vor der Zellteilung die DNA zu Chromosomen formt.
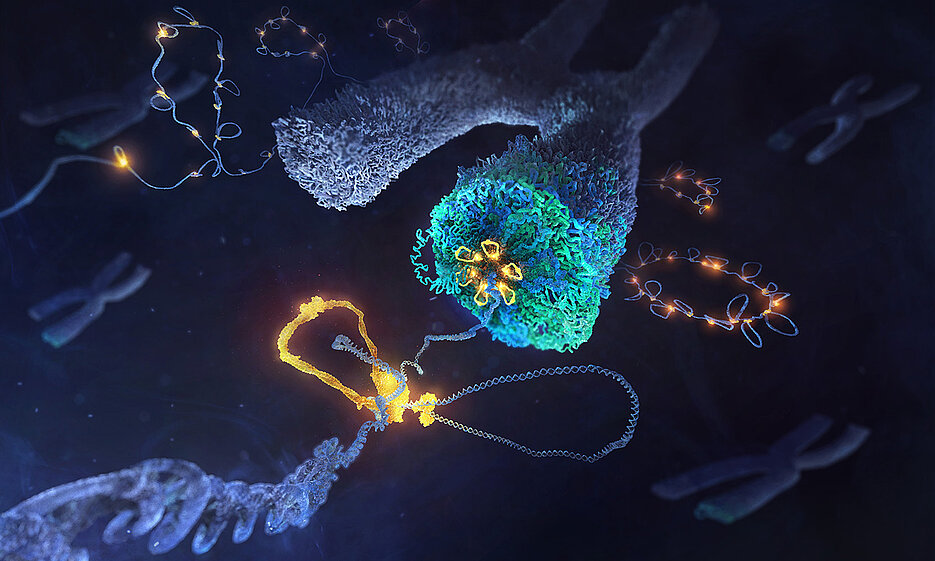
Die Zellen des Menschen vollbringen eine technische Höchstleistung, wenn es darum geht, Informationen auf kleinstem Raum unterzubringen. Jedes Mal, wenn sich eine Zelle teilt, bündelt sie die vier Meter lange DNA in 46 winzige Pakete, von denen jedes nur einige Millionstel Meter lang ist.
Forschungsgruppen des Europäischen Laboratoriums für Molekularbiologie EMBL Heidelberg und der Julius-Maximilians-Universität Würzburg (JMU) haben nun herausgefunden, wie es einer Familie von DNA-Motorproteinen gelingt, bei der Zellteilung lose angeordnete DNA-Stränge zu kompakten einzelnen Chromosomen zu verpacken.
Condensin formt Schleifen aus DNA
Die Forschenden untersuchten den Proteinkomplex Condensin, der für die Chromosomenbildung entscheidend ist. Obwohl dieser Komplex bereits vor mehr als drei Jahrzehnten entdeckt wurde, blieb seine Wirkungsweise lange Zeit unerforscht. Erst im Jahr 2018 zeigten Christian Häring und sein Team am EMBL Heidelberg, dass Condensin-Moleküle DNA-Schleifen formen – das war eine mögliche Erklärung für die Bildung der Chromosomen. Der Mechanismus, mit dem der Proteinkomplex dieses Kunststück vollbringt, blieb jedoch weiterhin unbekannt.
„Wir arbeiten schon seit langem an diesem Problem. Aber erst jetzt, durch die Kombination verschiedener experimenteller Ansätze, haben wir eine Antwort gefunden“, sagt Häring. Der ehemalige Gruppenleiter am EMBL Heidelberg ist inzwischen Professor am Biozentrum der JMU. Hier leitet er den Lehrstuhl für Biochemie und Zellbiologie.
Einzelne Moleküle bei der Arbeit beobachtet
Das Team hatte Erfolg mit sorgfältig konzipierten Experimenten. Dabei wurden auch einzelne Condensin-Moleküle beobachtet und manipuliert, während sie DNA-Schleifen formten. So kam heraus, wie verschiedene Teile des Komplexes gemeinsam als molekulare Maschine wirken: Ein Teil hält die DNA wie ein Anker fest, während der andere als Motor fungiert, der die DNA vorwärts bewegt und so eine lange Schleife erzeugt.
Wie andere Motorproteine bewegt sich Condensin in „Schritten“ entlang der DNA und verbrennt dabei zelluläre Energie in Form von ATP. Allerdings sind diese Schritte mehr als 500 Mal länger als die anderer DNA-Motorproteine, obwohl der Energieaufwand in etwa derselbe ist. „Das ist wie ein Formel-1-Rennwagen mit der Energieeffizienz eines E-Bikes“, sagt Indra Shaltiel. Der JMU-Forscher ist der Erstautor der Studie, die jetzt im Journal Science publiziert wurde.
Andere Prozesse im Erbgut laufen ähnlich ab
„Dank der Fortschritte in der Kryo-Elektronenmikroskopie konnten wir diesen komplexen Mechanismus in noch nie dagewesener Genauigkeit sichtbar machen“, sagt Seniorautor Sebastian Eustermann, Gruppenleiter am EMBL Heidelberg.
„Wir konnten Condensin in Aktion sehen und die molekulare Choreografie erkennen, mit der ATP seine Motoraktivität antreibt – ein wichtiger Schritt zum Verständnis der DNA-Schleifenbildung. Ähnliche Schleifen und verwandte molekulare Maschinen wurden in verschiedenen genomischen Prozessen nachgewiesen, unter anderem bei der Steuerung des Ein- und Ausschaltens von Genen zwischen Zellteilungen. Daher könnten unsere Ergebnisse noch weitreichendere Auswirkungen haben.“
Ein neues Forschungsgebiet tut sich auf
Condensine gehören zu einer der evolutionär ältesten Familien von Chromosomenproteinen. Die Entdeckung dieses neuen Mechanismus eröffnet ein völlig neues Forschungsgebiet.
„Die Mitglieder der Motorprotein-Klasse, zu der Condensin gehört, sind vermutlich essenziell für alles Leben auf der Erde“, so Häring. „Es ist offensichtlich, dass wir gerade erst anfangen zu verstehen, welche Rolle sie spielen und wie sie in den Zellen des Menschen beeinflusst werden könnten.“
Publikation
Shaltiel I., et al. “A hold-and-feed mechanism drives directional DNA loop extrusion by condensin”, Science, 2. Juni 2022, Vol 376, Issue 6597, pp. 1087-1094, DOI: 10.1126/science.abm4012
Kontakt
Prof. Dr. Christian Häring, Lehrstuhl für Biochemie und Zellbiologie, Biozentrum, Universität Würzburg, christian.haering@uni-wuerzburg.de