Protein BRCA1 als Stress-Coach
20.03.2019Zwei Proteine sorgen Hand in Hand dafür, dass die Tumorzellen des Neuroblastoms auf Hochtouren wachsen können. Wie sie das bewerkstelligen, zeigt ein Würzburger Forschungsteam in „Nature“.
Wer sich schon einmal näher mit den molekularen Grundlagen von Brustkrebs befasst hat, dem dürfte das Kürzel BRCA1 untergekommen sein. Dahinter verbirgt sich ein Protein, das die Zellen des Brustgewebes vor Krebs schützt. Überraschenderweise kann dieses Protein aber auch eine entgegengesetzte Wirkung haben: Bei einer anderen Krebsart, dem Neuroblastom, hilft es, den Tumor stabil zu halten. Das berichten Forschungsgruppen aus Würzburg, Göttingen und den Niederlanden in „Nature“.
Das Neuroblastom ist eine Krebserkrankung, die im frühen Kindesalter auftritt. Entartete Zellen des Nervensystems wachsen dabei im Bauchraum zu Geschwulsten heran; die Krankheit kann sehr unterschiedlich verlaufen. Weniger aggressive Tumore lassen sich gut behandeln oder bilden sich sogar spontan zurück. Dagegen sind die Überlebensaussichten für Kinder, deren Krebszellen das Tumorprotein MYCN aufweisen, besonders schlecht.
An Zellkulturen und Patienten untersucht
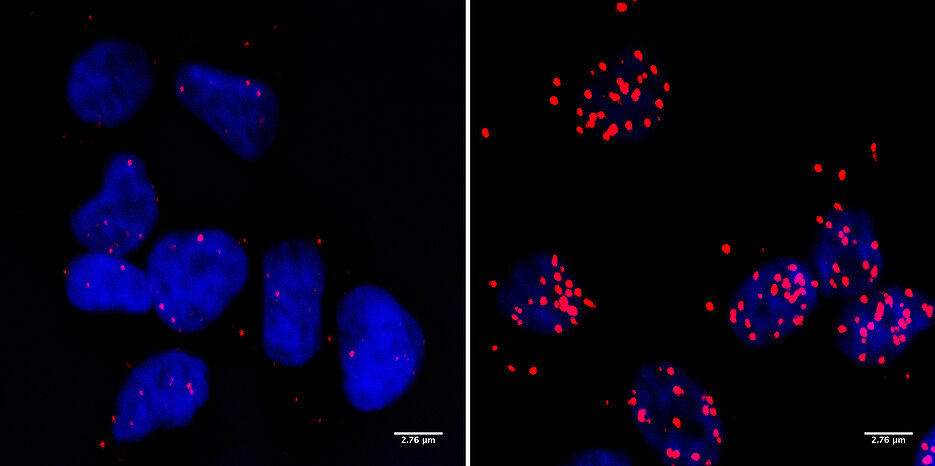
„In den aggressiven Neuroblastomen ist ein Zusammenwirken des Tumorproteins MYCN mit BRCA1 nötig, um den Tumor am Leben zu halten“, sagt Dr. Steffi Herold, wissenschaftliche Mitarbeiterin in der Arbeitsgruppe von Professor Martin Eilers am Biozentrum der Julius-Maximilians-Universität Würzburg (JMU). Das hat die Gruppe in Zellkulturen entdeckt. Auch in Gewebematerial von Patienten ließ sich das Ergebnis bestätigen: Tumoren von erkrankten Kindern, die hohe Mengen MYCN enthalten, weisen immer auch hohe Konzentrationen von BRCA1 auf. Das konnten Forscher aus Amsterdam und Utrecht zeigen, die mit der Gruppe von Professor Eilers kooperieren.
Das JMU-Team beschreibt in der Nature-Publikation den Mechanismus, über den das BRCA1-Protein Neuroblastomzellen am Leben erhält. Weil Krebszellen viel zu schnell wachsen und sich viel zu oft teilen, müssen sie ihren Stoffwechsel auf sehr hoher Geschwindigkeit laufen lassen. Das bedeutet Stress für die Zellen, und hier kommt BRCA1 ins Spiel: „Vereinfacht gesagt sorgt es dafür, dass die Zellen diesen Stress bewältigen können“, erklärt JMU-Postdoc Dr. Gabriele Büchel.
Bei Schäden öffnet BRCA1 ein Nebengleis
Genauer: In den Zellen des Neuroblastoms steuert nun das Protein MYCN die Transkription, also das Ablesen der genetischen Information im Zellkern. Diesen für die Zelle überlebenswichtigen Vorgang vergleicht Professor Eilers mit einem Zug, der auf einem Gleis fährt. „Gibt es am Gleis einen Schaden, kommt der Zug zum Stehen. Das Wachstum der Tumorzelle gerät ins Stocken, sie droht zu sterben.“ Das Protein BRCA1 sorge in diesem Fall dafür, dass eine Weiche zu einem Nebengleis geöffnet wird. So kann der Zug ausweichen, bis die Tumorzelle den Schaden am Hauptgleis repariert hat.
Hand in Hand sorgen die Proteine MYCN und BRCA1 also dafür, dass der Stoffwechsel der Tumorzellen immer weiter auf Hochtouren laufen kann. Darauf wurde das JMU-Team aufmerksam, als es in Neuroblastomzellen nach bislang unbekannten Angriffspunkten suchte, über die sich das Tumorwachstum hemmen lässt.
Viele weitere Fragen sind zu klären
Patienten mit einem Neuroblastom können von diesen neuen Erkenntnissen zwar nicht unmittelbar profitieren, aber das Team von Eilers wird das Thema weiter verfolgen und erwartet, dass sich aus den Erkenntnissen neue Therapieansätze ergeben. Es will auch klären, ob die Kooperation der Proteine MYCN und BRCA1 nur bei Neuroblastomen auftritt oder ob hier ein genereller Mechanismus vorliegt, der auch bei anderen Krebsarten zum Tragen kommt. Dr. Herold will dazu unter anderem Zellen des Prostatakrebses analysieren, weil auch hier das Auftreten des Tumorproteins MYCN mit einer aggressiven und schwer behandelbaren Form des Tumors verbunden ist.
Doktorandin Jacqueline Kalb wird sich damit befassen, wie der genaue Mechanismus der Zusammenarbeit zwischen den beiden Proteinen aussieht und ob noch andere Proteine beteiligt sind als die in „Nature“ beschriebenen. Und Dr. Büchel wird von MYCN „angetriebene“ Neuroblastome daraufhin untersuchen, ob man ihre Stresslage ausnutzen kann, um die bislang unzureichenden Therapien zu verbessern.
Diese Arbeiten wurden unter anderem vom Europäischen Forschungsrat (im Rahmen eines ERC Grants für Professor Eilers) und von der Deutschen Krebshilfe finanziell gefördert.
Publikation
Recruitment of BRCA1 limits MYCN-driven accumulation of stalled RNA Polymerase. Nature, online publiziert am 20. März 2019, DOI 10.1038/s41586-019-1030-9
Förderer
Europäischer Forschungsrat / European Research Council (AuroMYC), Deutsche Krebshilfe / German Cancer Aid (111300), Bundesministerium für Bildung und Forschung BMBF / Federal Ministry of Education and Research (SYSMED), Deutsche Forschungsgemeinschaft DFG / German Research Foundation (WO 2108/1-1)
Kontakt
Prof. Dr. Martin Eilers, Biozentrum der Universität Würzburg, T +49 931 31-84111
Martin.Eilers@biozentrum.uni-wuerzburg.de
Dr. Steffi Herold, Biozentrum der Universität Würzburg, T +49 931 31-88072
s.herold@uni-wuerzburg.de