Neurodegeneration bei Myelin-Erkrankungen: Kein Myelin ist besser als schlechtes Myelin
28.11.2023Der Verlust von Myelin gilt als Ursache einiger Erkrankungen des Nervensystems. Aber: Die Entfernung von erkranktem Myelin kann das Überleben von Nervenfasern erlauben, wie Wissenschaftler der Würzburger Universitätsklinik zeigen.
Myelin ist eine isolierende Schicht um die Fortsätze, die Nervenzellen verbinden - die sogenannten Axone. Es erlaubt die schnelle Weiterleitung von elektrischen Signalen und unterstützt die Integrität und Funktion dieser Zellen. Im zentralen Nervensystem wird Myelin von spezialisierten Gliazellen namens Oligodendrozyten gebildet.
Störungen an dieser Isolierschicht sind wesentliche Begleiterscheinung vieler, oft chronischer Erkrankungen des Nervensystems. Ein Paradebeispiel ist die Multiple Sklerose, eine schwerwiegende und häufige neurologische Erkrankung, bei der Immunzellen den Verlust des Myelins antreiben. Fehlgeleitete Immunreaktionen tragen allerdings auch zu anderen Beschwerden bei, die mit Myelin-Defekten verbunden sind – unter anderem zu erblichen und altersbedingten Krankheiten.
Dabei gleichen sich diese Krankheiten in einem wesentlichen Merkmal: Bei den Betroffenen degenerieren Axone und Neurone. Laut allgemeiner Auffassung führt der Verlust des Myelins zu einer gesteigerten Verwundbarkeit und schließlich dem Absterben der entblößten Axone und deren Zellkörper, forciert durch ein toxisches, entzündliches Milieu.
Publikation in Nature Communications
Diese Sichtweise, die die negativen Seiten der Demyelinisierung in den Vordergrund stellt, wird allerdings jetzt von einer neuen Studie relativiert, die an der Neurologischen Klinik des Universitätsklinikum Würzburg in der Sektion „Experimentelle Entwicklungsneurobiologie“ (Leitung: Prof. Dr. Rudolf Martini) durchgeführt wurde.
Die Federführung lag dabei bei Privatdozent Dr. Janos Groh; daran beteiligt waren das Institut für Molekulare Neurobiologie der TU München (Prof. Dr. Mikael Simons), Professor Antoine-Emmanuel Saliba vom Helmholtz-Institut für RNA-basierte Infektionsforschung (Würzburg) und Forschungsteams aus Hannover und Cambridge.
In der Fachzeitschrift Nature Communications haben die Wissenschaftler die Ergebnisse ihrer Untersuchungen veröffentlicht.
Myelin-Gendefekte lösen prägnante Immunreaktionen aus
Um das Verhältnis zwischen dem Verlust von Myelin und axonaler Degeneration zu untersuchen, haben die Wissenschaftler Mausmodelle seltener Krankheiten studiert, die Defekte im häufigsten Myelin-Protein des zentralen Nervensystems tragen. „Diese Modelle seltener monogenetischer Krankheiten bieten einzigartige Gelegenheiten, um Mechanismen aufzuklären, die umfassende Relevanz für viel häufigere Erkrankungen und sogar Alterungsprozesse haben“, sagt Rudolf Martini.
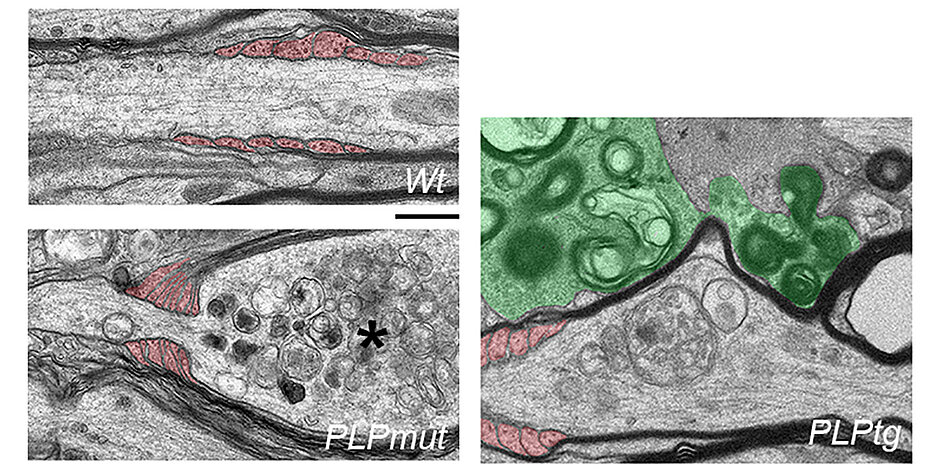
Die Forscher hatten zuvor entdeckt, dass die Bildung von abnormem oder „schlechtem“ Myelin zu einer Entzündungsreaktion führt, die mit einer Ansammlung spezieller, zellschädigender Immunzellen einhergeht – der sogenannten CD8+-T-Zellen. In den untersuchten Krankheitsmodellen attackieren und schädigen diese Immunzellen Fasersegmente mit abnormem Myelin, ähnlich wie bei der Multiplen Sklerose.
Überraschenderweise und im Widerspruch zur vorherrschenden Sichtweise, fanden die Forscher eine umgekehrte Beziehung zwischen axonalem Verlust und Demyelinisierung beim Vergleich der Krankheitsmodelle. Fasern, die trotz chronischer Attacke durch T-Zellen myelinisiert blieben, hatten ein höheres Risiko abzusterben, wohingegen jene mit Myelin-Verlust überlebten. Außerdem korrelierten Verhaltensdefizite der Mäuse deutlicher mit dem Verlust von Nervenzellen als mit der Demyelinisierung.
Beständiges abnormes Myelin als Risikofaktor für axonale Degeneration
„Diese umgekehrte Beziehung war unerwartet und hat uns dazu verleitet, die Interaktionen von abnormen Oligodendrozyten und einem weiteren Immunzelltyp, der sogenannten Mikroglia, näher zu untersuchen“ erklärt Janos Groh. Mikroglia sind Zellen des angeborenen Immunsystems, die das zentrale Nervensystem besiedeln und schädliche, aber auch hilfreiche Immunreaktionen organisieren können.
In ihrer Studie benutzten die Autoren unterschiedliche pharmakologische Ansätze, um die Entfernung von abnormem Myelin durch Mikroglia zu modulieren. „Wir zeigen, dass die effiziente, von Mikroglia vermittelte Entfernung des gestörten Myelins, das von adaptiven Immunzellen angegriffen wird, das Überleben von Axonen in reversiblen Stadien der Schädigung ermöglicht“, fügt Groh hinzu. Die andauernde Umhüllung mit „schlechtem” Myelin scheint also schädlicher für Neurone zu sein als der Verlust des Myelins, zumindest wenn Myelin durch adaptive Immunität ins Visier genommen wird.
Oligodendrozyten, die von Immunzellen angegriffen werden, schädigen aktiv Axone
Die Wissenschaftler konnten auch einen Mechanismus identifizieren, wie die von T-Zellen attackierten Oligodendrozyten ihre axonalen Partner beeinträchtigen. Sie fanden eine ungewöhnliche Einschnürungsreaktion an den Myelin-bildenden Fortsätzen, die sich um die Axone wickeln. „Wenn wir diese irrtümliche Einschnürung verhinderten, konnten wir die axonale Degeneration reduzieren“, fasst Groh zusammen. „Die Attacke durch T-Zellen scheint die Oligodendrozyten dazu anzustiften, Axone wie eine Würgeschlange zu strangulieren“ fügt Martini hinzu.
„Was ist der ‚biologische Sinn‘ dieser hoch organisierten aber selbstverstümmelnden Prozesse?“, fragt sich der Grundlagenwissenschaftler Martini. Die Forscher vermuten, dass diese Reaktionen der Oligodendrozyten unter anderen Umständen hilfreich sein können, beispielsweise nach Verletzungen des Nervensystems. Die irrtümliche Einleitung dieser immunvermittelten Mechanismen könnte allerdings eine schädliche Reaktion in vielen Krankheiten darstellen.
Laut Groh und Martini hat ihre Studie mögliche Zielpunkte für die Therapie von Erkrankungen, die mit Myelin-Defekten und Entzündung im Nervensystem verbunden sind, identifiziert. Außerdem betonen sie, dass neue Therapieansätze für Myelin-Erkrankungen idealerweise schädliche Immunreaktionen blockieren, aber nützliche Immunreaktionen wie die Entfernung von „schlechtem“ Myelin weiterhin zulassen sollten. Das könnte dabei helfen, Mechanismen der neuralen Resilienz als Voraussetzung für die Erholung von Schäden in Nervensystem zu fördern.
Originalpublikation
Microglia-mediated demyelination protects against CD8+ T cell-driven axon degeneration in mice carrying PLP defects. Janos Groh, Tassnim Abdelwahab, Yogita Kattimani, Michaela Hörner, Silke Loserth, Viktoria Gudi, Robert Adalbert, Fabian Imdahl, Antoine-Emmanuel Saliba, Michael Coleman, Martin Stangel, Mikael Simons & Rudolf Martini. Nature Communications 14, 6911 (2023). https://doi.org/10.1038/s41467-023-42570-2; https://rdcu.be/dqEk4
Kontakt
PD Dr. Janos Groh, Principal Investigator am Institut für Molekulare Neurobiologie, Technische Universität München, T: +49 89 4400 46481, janos.groh@tum.de
Prof. Dr. Rudolf Martini, Senior Professor an der Neurologischen Klinik, Universitätsklinikum Würzburg., T: +49 931 201 23268, rudolf.martini@uni-wuerzburg.de