Neun auf einen Streich
04.02.2016Fortschritt für die biomedizinische Bildgebung: Im Biozentrum der Uni Würzburg wurde die Fluoreszenzmikroskopie so weiterentwickelt, dass sich jetzt bis zu neun verschiedene Zellstrukturen gleichzeitig markieren und abbilden lassen.
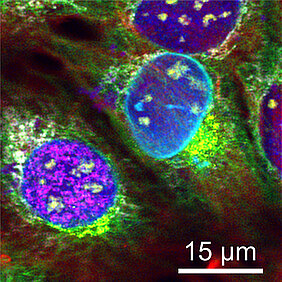

Mit der Fluoreszenzmikroskopie können Forscher Biomoleküle in Zellen sichtbar machen. Sie markieren die Moleküle mit fluoreszierenden Sonden, regen diese mit Licht an und nutzen die dadurch ausgelöste Fluoreszenz, um ein mikroskopisches Bild von den Strukturen der Zelle zu gewinnen.
„Eine große Schwierigkeit dabei ist die eindeutige Unterscheidung der vielen fluoreszierenden Sonden, die sich teilweise sehr ähnlich sind“, sagt Thomas Niehörster, Doktorand bei Professor Markus Sauer am Lehrstuhl für Biotechnologie und Biophysik der Universität Würzburg.
Worauf die neue Strategie basiert
Um hier Fortschritte zu erzielen, haben die Wissenschaftler eine neue Strategie entwickelt. Sie verwenden zur Anregung der Sonden jetzt drei abwechselnd gepulste Laser mit verschiedenen Wellenlängen (blau, grün und rot). Zusätzlich nutzen sie Unterschiede im Emissionsspektrum der Sonden und das zeitlich leicht unterschiedliche Abklingen der Fluoreszenz aus, das sich im Bereich von wenigen Nanosekunden bewegt.
Aus diesem Versuchsaufbau erhalten sie komplexe Daten, die sie mit einer selbstgeschriebenen Software analysieren. Das ganze Verfahren namens sFLIM (spectrally resolved fluorescence lifetime imaging microscopy) funktioniert offenbar bestens: „Am Ende können wir die fluoreszierenden Sonden mit bisher unerreichter Genauigkeit voneinander unterscheiden“, sagt Professor Sauer.
Was mit dem Verfahren machbar ist
Auf diese Art lassen sich mit jedem der drei Laser jeweils fünf Fluoreszenzsonden unterscheiden, so dass theoretisch 15 verschiedene Strukturen gleichzeitig darstellbar wären.
In der Praxis aber müssen sich die Forscher mit weniger zufriedengeben: „Es ist schwierig, so viele verschiedene Zellstrukturen gleichzeitig zu markieren, und es gibt dafür auch nur eine begrenzte Zahl von Sonden“, erklärt Niehörster. „Trotzdem ist es uns gelungen, neun Strukturen gleichzeitig zu markieren und abzubilden.“ Dazu gehören zum Beispiel das F-Actin-Proteingerüst des Zellskeletts, die Hülle des Zellkerns oder neu entstehende DNA.
Durch die hohe Empfindlichkeit des Verfahrens können außerdem drei verschiedene Zellstrukturen gleichzeitig mit demselben Fluoreszenzfarbstoff markiert und am Ende trotzdem klar unterschieden werden. Das liegt daran, dass sich die Fluoreszenzeigenschaften je nach chemischer Umgebung in der Zelle geringfügig verändern und damit unterscheidbar werden.
Kooperation mit Wirtschaft und Wissenschaft
Dieses Ergebnis kam durch eine Kooperation des Würzburger Lehrstuhls mit der Universität Göttingen (Software) und der Firma PicoQuant in Berlin (Hardware-Aufbau) zu Stande. Veröffentlicht ist es im Fachmagazin „Nature Methods“.
„Multi-target spectrally resolved fluorescence lifetime imaging microscopy”, Thomas Niehörster, Anna Löschberger, Ingo Gregor, Benedikt Krämer, Hans-Jürgen Rahn, Matthias Patting, Felix Koberling, Jörg Enderlein & Markus Sauer, Nature Methods (2016), doi:10.1038/nmeth.3740
Kontakt
Prof. Dr. Markus Sauer, Lehrstuhl für Biotechnologie und Biophysik, Universität Würzburg, T (0931) 31-88687