Neuer Wirkmechanismus von Antidepressiva entdeckt
22.09.2016Forscher des Instituts für Virologie und Immunbiologie an der Uni Würzburg haben einen neuen Wirkmechanismus von Antidepressiva entdeckt. Die im Fachmagazin "Journal of Immunology" veröffentlichte Arbeit könnte den Weg zum Einsatz auch bei Entzündungen und Autoimmunerkrankungen weisen.
Membranen spielen eine wichtige strukturelle und funktionelle Rolle bei allen Zellen eines Organismus. Sie grenzen die Zelle nach außen hin ab, bilden intrazelluläre Kompartimente, die miteinander fusionieren oder sich teilen können, und — je nach eingebauten Komponenten — für mehr oder weniger Flexibilität sorgen.
Sphingolipide, zu denen auch die Ceramide gehören, sind die häufigsten Lipidbausteine dieser Membranen. Ceramide und Abbauprodukte wie Sphingosin und Sphingosin-1-Phosphat können auch Signale übertragen, die unter anderem die Zellteilung und Bewegung regulieren.
Der Metabolismus der Sphingolipide wird durch eine Reihe von Enzymen reguliert, die sehr schnell auf äußere und innere Reize reagieren können und die Membranzusammensetzung an die Bedürfnisse der Zellen anpassen.
Natürliche Defekte in beteiligten Enzymen können zu Erkrankungen führen, wie etwa ein Defekt der sauren Sphingomyelinase (ASM) zur Niemann-Pick-Krankheit, bei der sich Sphingomyelin in Lysosomen von Zellen der Leber, Milz, Knochenmark und Gehirn ablagert und zum Tode führen kann (die lysosomale Speicherkrankheit kann je nach Schwere des Defekts unterschiedliche Verläufe haben).
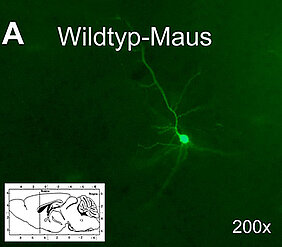
Frühere Arbeiten haben belegt, dass Veränderungen im Sphingolipid-Metabolismus auch Infektionen und das Immunsystem beeinflussen können. Deshalb untersuchten die Arbeitsgruppen von Jürgen Schneider-Schaulies und Niklas Beyersdorf im Rahmen der von der Deutschen Forschungsgemeinschaft (DFG) geförderten Forschergruppe FOR2123 am Institut für Virologie und Immunbiologie in Würzburg an einem Infektionsmodell des zentralen Nervensystems mit Masernviren in der Maus, ob das Fehlen der ASM (genetische Defizienz) den Infektionsverlauf ändert.
Mehr infizierte Nervenzellen in ASM-defizienten Tieren
Tatsächlich fanden sie sehr viel mehr infizierte Nervenzellen im Gehirn der ASM-defizienten Tiere. Weiterhin wurde die Rolle der Sphingolipide und Auswirkungen der Hemmung verschiedener Enzyme des Sphingolipidmetabolismus auf die zelluläre Immunantwort untersucht. "Die Ergebnisse zeigten, dass sowohl eine genetische Defizienz, wie auch eine pharmakologische Hemmung der ASM mit einem Antidepressivum wie Amitriptylin die Frequenz und Aktivität regulatorischer T-Zellen erhöht, beziehungsweise die Zahl konventioneller T-Zellen erniedrigt und dadurch das Verhältnis regulatorischer zu konventionellen T-Zellen erhöht", erklärt Jürgen Schneider-Schaulies.
Regulatorische T-Zellen sind für eine Begrenzung und Beendigung der zellulären Immunreaktion unabdingbar. Generell ist die Balance zwischen den verschiedenen T-Zell-Populationen ein wichtiger Faktor für ein funktionierendes Immunsystem. Abwesenheit regulatorischer T-Zellen führt zu Autoimmunerkrankungen, wogegen zu viele regulatorische T-Zellen eine effiziente Immunreaktion gegen Infektionen verhindern. "Die Hemmung der ASM hat also eine moderate Hemmung der Immunantwort (Immunsuppression) zur Folge", sagt Jürgen Schneider-Schaulies.
Untersuchung der Immunreaktion bei Menschen muss folgen
"Diese eindeutigen Ergebnisse wurden bislang in Mäusen und mit Immunzellen der Maus erzielt. Ob die Immunreaktion in Menschen ähnlich auf solche Inhibitoren reagiert, muss erst noch untersucht werden".
Die Befunde legten laut Jürgen Schneider-Schaulies und Niklas Beyersdorf nahe, dass ASM-hemmende Substanzen wie Amitriptylin als potentielle immunmodulatorische Therapeutika für die Therapie entzündlicher und autoimmuner Erkrankungen in Betracht gezogen werden könnten. Interessanterweise werden manche Formen von Depressionen mit entzündlichen Vorgängen in Verbindung gebracht, sodass der die Immunantwort dämpfende Effekt der ASM Hemmstoffe hier einen entscheidenden Beitrag zur Behandlung der Erkrankung leisten könnte.
"Da viele Patienten diesen oder ähnliche Inhibitoren einnehmen, ist es von großem allgemeinem Interesse, die damit verbundenen Wirkungen und Nebenwirkungen auch zu untersuchen und zu wissen, wie sie optimal ausgenutzt werden könnten", sagt Jürgen Schneider-Schaulies.
Hollmann, C., Werner, S., Avota, E., Reuter, D., Japtok, L., Kleuser, B., Gulbins, E., Becker, K.A., Schneider-Schaulies, J., and Beyersdorf, N. (2016). "Inhibition of acid sphingomyelinase allows for selective targeting of CD4+ conventional versus Foxp3+ regulatory T cells." J Immunol. Sept. 16. Pii: 1600691.
Kontakt
Prof. Dr. Jürgen Schneider-Schaulies, Institut für Virologie und Immunbiologie, T.: +49-931-3181564
E-Mail: jss@vim.uni-wuerzburg.de