Ein Schwamm in der Abwehr
03.02.2022Bakterien verfügen über zahlreiche Tricks, um sich optimal an ihre jeweilige Umgebung anzupassen. Einen ganz neuen hat jetzt ein Würzburger Forschungsteam entdeckt: Eine Art Schwamm, der bestimmte Boten aufsaugt.
Weltweit sterben jedes Jahr mindestens 1,27 Millionen Menschen an einer Infektion mit Bakterien, die gegen die gängigen Antibiotika resistent sind. Dies zeigt eine jüngst in der Fachzeitschrift The Lancet veröffentlichte Studie. Die Autoren befürchten, dass diese Zahl bis 2050 auf zehn Millionen steigen könnte.
Die Suche nach neuen Wirkstoffen gegen resistente Bakterienstämme ist deshalb dringender denn je. Ein möglicher Ansatz dabei sind programmierbare Antibiotika auf der Basis von RNA. Dieser erfordert aber ein umfassendes Verständnis der wichtigsten RNA-basierten Signalwege und Mechanismen im Verlauf einer Infektion.
Neue Signalwege entschlüsselt
In Würzburg wird daran unter anderem am Institut für molekulare Infektionsbiologie (IMIB) der Universität und am Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) geforscht. Jetzt ist es Wissenschaftlern im Labor von Professor Jörg Vogel, Inhaber des Lehrstuhls für Molekulare Infektionsbiologie I der JMU und geschäftsführender Direktor des HIRI, gelungen, neue Details dieser Signalwege und Mechanismen zu entschlüsseln. In der neuesten Ausgabe der Fachzeitschrift Molecular Cell stellen sie die Ergebnisse ihrer Untersuchungen vor.
„Viele Bakterien wie beispielsweise Escherichia coli und Salmonella enterica besitzen eine Zellhülle, die aus einer äußeren und einer inneren Membran besteht. Hauptaufgabe dieser Hülle ist es, die Bakterien von ihrer Umgebung abzuschirmen; gleichzeitig muss sie aber auch für Nährstoffe durchlässig sein, die das Bakterium zum Leben benötigt“, schildert Gianluca Matera, Doktorand am IMIB, den Hintergrund der jetzt veröffentlichten Arbeit, für die er gemeinsam mit Vogel verantwortlich ist.
Ein bislang unbekannter Mitspieler
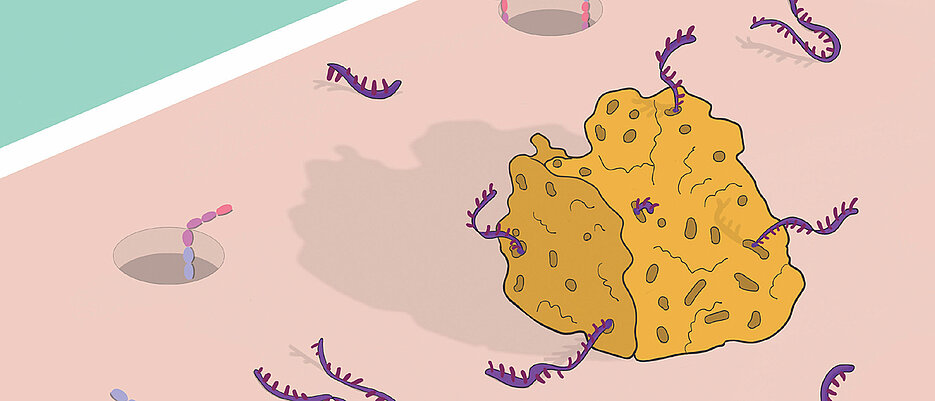
Welche Substanzen zu welchem Zeitpunkt die Zellhülle passieren dürfen, welche das Bakterium abblockt und wie es sich auf diese Weise beispielsweise auch vor dem Angriff von Antibiotika schützt: Dafür ist ein komplexes Zusammenspiel zahlreicher RNA-Akteure verantwortlich. Einen bislang unbekannten Mitspieler, mit dem bisher niemand gerechnet hatte, hat das Forschungsteam jetzt im Bakterium Salmonella enterica identifiziert: einen „RNA-Schwamm“.
Solche Schwämme zählen zur Klasse der „kleinen RNAs“. Wie die Würzburger Studie zeigt, imitiert der RNA-Schwamm OppX das eigentliche Bindungsziel einer speziellen sRNA – der sogenannten MicF sRNA – in der bakteriellen Außenmembran und kann diese somit abfangen, bevor sie ihr eigentliches Ziel erreicht. Anders formuliert, saugt er sie auf wie ein Schwamm.
Kommunikation der Membranen
Die MicF sRNA spielt eine wichtige Rolle in den Prozessen der Bakterienhülle. „Äußere und innere Membran der Bakterienhülle können ja nicht getrennt voneinander arbeiten. Es muss deshalb Mechanismen geben, damit diese miteinander kommunizieren können. Eine Klasse solcher Regulatoren sind kleine nicht-kodierende RNAs, wie beispielsweise MicF“, erklärt Gianluca Matera. Mit Hilfe einer an der Hebräischen Universität in Jerusalem neu entwickelten Methode hat der Nachwuchswissenschaftler jetzt die Interaktionspartner all dieser sRNAs in Salmonella umfassend und in einem einzigen Schritt identifiziert.
Den Effekt dieses Abfangprozesses können die Wissenschaftlerinnen und Wissenschaftler exakt beschreiben: „Normalerweise erhöht OppX die Durchlässigkeit der Membran, indem es die Expression einer der Hauptporen in der bakteriellen Außenmembran steigert“, erklärt Matera. Der wissenschaftliche Name dieser Pore lautet OmpF.
Fehlt dem Bakterium der OppX-Schwamm, ist sein Wachstum besonders in einer nährstoffarmen Umgebung eingeschränkt. Ist jedoch OppX in ausreichender Menge vorhanden, werden auch die OmpF-Poren in der Membran aktiver, was wiederum die Aufnahme von Nährstoffen bei einer reduzierten Verfügbarkeit steigert.
Indirekter Einfluss auf Antibiotika
Auch bei einem Antibiotika-Angriff kommt den OmpF-Poren eine besondere Rolle zu: Vor allem über sie gelingt den feindlichen Wirkstoffen der Eintritt ins Zellinnere. „Indirekt könnte OppX einen Einfluss auf die Wirksamkeit von Antibiotika haben, indem es die OmpF-Produktion und damit die Aufnahme des Antibiotikums selbst erhöht“, erklärt Matera.
OppX ist der erste bisher bekannte derartige Regulator der MicF-Aktivität – tatsächlich sprechen die jetzt veröffentlichten Daten sogar dafür, dass OppX der wichtigste, wenn nicht sogar der einzige Schwamm für die MicF sRNA ist. Ohne dessen Kenntnis könne die zelluläre Aktivität von MicF deshalb nicht vollständig verstanden werden, so die Autoren der Studie.
Bislang beruhen diese neuen Erkenntnisse auf Untersuchungen von Bakterien, die unter Laborbedingungen in vitro gezüchtet wurden. Die Herausforderung bestehe nun darin, diese Untersuchungen auf „realistischere“ Bedingungen auszuweiten. Den ersten Schritt dazu haben die Beteiligten dazu bereits gemacht: „Wir entschlüsseln derzeit das RNA-Interaktom von Salmonella in infizierten Wirtszellen“, erklärt Jörg Vogel. „Antibiotikaresistenzen gehören zu den großen gesundheitlichen Bedrohungen unserer Zeit. Deshalb wollen wir mit unserer Grundlagenforschung dazu beitragen, dass neue Therapeutika entwickelt werden können.“
Originalpublikation
Global RNA interactome of Salmonella discovers a 5’ UTR sponge for the MicF small RNA that connects membrane permeability to transport capacity. Matera G, Altuvia Y, Gerovac M, El Mouali Y, Margalit H, Vogel J (2022). Molecular Cell, https://doi.org/10.1016/j.molcel.2021.12.030
Kontakt
Prof. Dr. Jörg Vogel, Helmholtz-Institut für RNA-basierte Infektionsforschung, T +49 931 31-82575, joerg.vogel@uni-wuerzburg.de
Matera Gianluca, Institut für molekulare Infektionsbiologie, T +49 931 31-86936, gianluca.matera@uni-wuerzburg.de