Die Auflösung eines molekularen Orchesters
03.08.2022Forscher der Universität Würzburg entwickeln den neuen „Photoswitching Fingerabdruck“, der erstmals die molekulare Kommunikation in Zellen visualisiert und die biomedizinische Forschung revolutioniert.
Es ist eine einzigartige Technologie, die erstmals die Untersuchung molekularer Vorgänge und der Regulation einzelner Proteine in lebenden Zellen mit sub-zehn Nanometer räumlicher Auflösung ermöglicht. Die Anwendung erstreckt sich von der biologischen bis hin zur medizinischen Forschung und wurde in dem renommierten Fachjournal Nature Methods veröffentlicht.
Die hochauflösende Fluoreszenzmikroskopie (Super-Resolution Microscopy) erlaubt es, Fluoreszenzbilder von Zellen, Organellen und Molekülkomplexen mit bisher unerreichter räumlicher Auflösung aufzunehmen. Diese Auflösung reicht jedoch nicht, um Proteine mit einer Größe von wenigen Nanometern und ihre Wechselwirkungen mit anderen Molekülen oder die Architektur von Proteinkomplexen aufzulösen. Es limitiert zum Beispiel die Erforschung des molekularen Zusammenspiels der Neuronen in Lern- und Gedächtnisprozessen.
Dynamische Auflösungsgrenzen überwinden
Entwickelt von der Forschungsgruppe von Professor Markus Sauer (Rudolf-Virchow-Zentrum und Biozentrum) und Dr. Gerti Beliu (Rudolf-Virchow-Zentrum) der Universität Würzburg, ermöglicht der neue Photoswitching Fingerabdruck die optische Darstellung von dynamischen Wechselwirkungen mit anderen Molekülen in der Zelle. „Bisher existiert keine Methode, die eine strukturelle optische Auflösung in Zellen im sub-zehn Nanometer Bereich verlässlich erlaubt. Durch die Aufklärung dieser Barriere zugrundeliegenden Ursache ist es uns erstmals gelungen, in Kombination mit neuen direkten Markierungsmethoden, eine zelluläre Auflösung von wenigen Nanometern zu realisieren. Dieser Fortschritt ermöglicht die Aufklärung molekulare Funktionen und der Architektur wichtiger Komponenten unserer Zellen“, berichtet Sauer.
Einzelmolekül-Lokalisations-Mikroskopiemethoden (single-molecule localization microscopy methods) wie dSTORM, die in der Arbeitsgruppe von Markus Sauer entwickelt wurden, ermöglichen Auflösungen im Bereich von zehn bis 20 Nanometern. In Kombination mit strukturierten Beleuchtungsverfahren konnten Lokalisationsgenauigkeiten von bis zu einem Nanometer für Farbstoffe erreicht werden. Leider konnte diese hohe Lokalisationspräzision nicht in eine räumliche Auflösung von wenigen Nanometern in Zellen übersetzt werden.
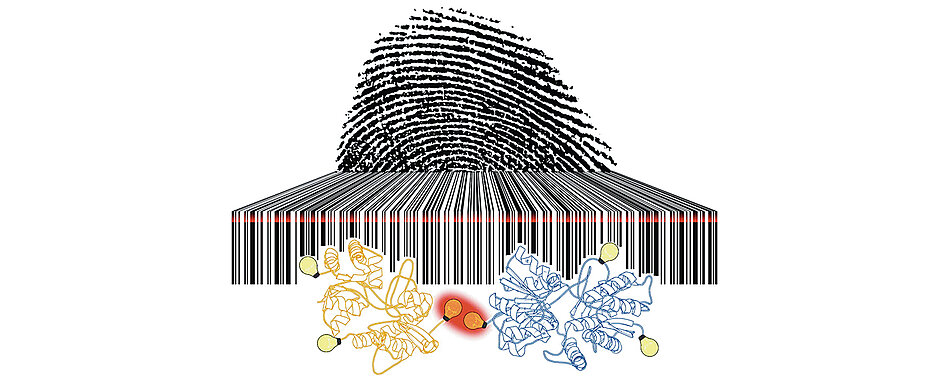
Das Problem: Die gängigen Markierungsmethoden, zum Beispiel Immunfärbungen mit einem Antikörper, verursachen einen Abstandsfehler von mehr als zehn Nanometern. Dadurch verhindert die Größe der Markierungsmoleküle eine Auflösung im Nanometerbereich. Die Ursache für die sub-zehn Nanometer Auflösungsbarriere war bisher nicht bekannt. „In unserer Publikation konnten wir nun erstmals zeigen, dass die Photoschaltraten (Blinking) der Farbstoffe zwischen einem An- und Aus-Zustand bei Abständen unterhalb von zehn Nanometern aufgrund verschiedener Energietransferprozesse zwischen Farbstoffen stark beeinflusst werden. Hierdurch kommt es während den ersten Sekunden eines Experiments gehäuft zu An-Zuständen und damit verbunden zum schnellen Photobleichen der Farbstoffe, was ihre individuelle Lokalisation erschwert“, erklärt Sauer. „Die verringerte Lokalisationswahrscheinlichkeit der Farbstoffe resultiert daher in einer schlechteren strukturellen Auflösung, als man aufgrund der individuellen Lokalisationsgenauigkeit erwarten würde. Dies ähnelt einem Orchester, indem alle Instrumente zeitgleich am Anfang des Stücks ihre Beiträge spielen; es ist unmöglich die einzelnen Tonspuren herauszuhören.“
Die Fluoreszenzintensitätsspur
Der Photoswitching Fingerabdruck (Photoswitching Fingerprint) und die Fluoreszenzabklingdauer enthalten aber auch Information über die Anzahl der vorhandenen Farbstoffe und, aufgrund der Abstandabhängigkeit der Energietransferprozesse, auch Information über deren Abstände, ohne dass man die einzelnen Farbstoffe optisch auflösen kann. Durch den Einbau unnatürlicher Aminosäuren in multimere Membranrezeptoren durch Erweiterung des genetischen Codes (Genetic Code Expansion) mit anschließender bioorthogonaler Click-Markierung mit kleinen Fluoreszenz-Farbstoffen konnten die Würzburger Forschungsgruppen nun im nächsten Schritt aufzeigen, wie die spezifische ortsgenaue Markierung von Proteinen in Zellen ohne Abstandsfehler mit sub-zehn Nanometer Abständen gelingt. „Durch die Analyse der Photoswitching Fingerprints der multimeren Rezeptoren in der Plasmamembran konnten wir so erstmals Abstände zwischen Rezeptoruntereinheiten im Bereich von fünf bis sieben Nanometern in Zellen abschätzen und die Anzahl der markierten Untereinheiten bestimmen“, sagt Beliu.
Molekulare Kommunikation visualisieren und verstehen
Im nächsten Schritt will das Forschungsteam die Photoswitching-Fingerprint-Analyse optimieren und in Kombination mit der Einzelmolekül-Lokalisations-Mikroskopie mittels strukturierter Beleuchtung und DNA-PAINT zum verlässlichen Super-Resolution-Imaging in Zellen mit sub-zehn Nanometer Auflösung einsetzen. Dies soll neue Erkenntnisse in der molekularen Organisation zellulärer Strukturen, Organellen und Multiproteinkomplexe sowie der Strukturaufklärung von Proteinkomplexen mit optischen Methoden ermöglichen.
Die neu entwickelte Methode bietet nicht nur einzigartige Einblicke in molekulare Mechanismen der Infektions-, Lipid- und Krebsforschung: Der Photoswitching Fingerabdruck hat auch das Potential, die Dynamik und Komplexität von Rezeptoren im Nervensystem, die an den Synapsen der Neurone für die Signalweiterleitung wichtig sind, realistischer darzustellen. Dieses Zusammenspiel der Neuronen definiert unsere täglichen Lern- und Gedächtnisprozesse. „Es ist daher fundamental wichtig, zu verstehen, wie sich dieses molekulare Orchester zusammensetzt und funktioniert“, beschreibt Beliu die Bedeutung dieser Forschungsergebnisse.
Die Technologie wird im September während des Translational-Bioimaging-Symposiums im Rudolf-Virchow-Zentrum von Markus Sauer präsentiert: https://www.uni-wuerzburg.de/rvz/bioimaging2022/
Förderung
Die Studie wurde aus Mitteln des European Research Council (ERC, under the European Union’s Horizon 2020 research and innovation programme, grant agreement No 835102) und von der Deutsche Forschungsgemeinschaft (DFG SA829/19-1) gefördert.
Publikation
Photoswitching fingerprint analysis bypasses the 10 nm resolution barrier. Dominic Helmerich, Gerti Beliu, Danush Taban, Mara Meub, Marcel Streit, Alexander Kuhlemann, Sören Doose and Markus Sauer. Nature Methods, August 2022. doi.org/10.1038/s41592-022-01548-6
Kontakt
Prof. Dr. Markus Sauer, Rudolf Virchow Center - Center for Integrative and Translational Bioimaging und Lehrstuhl für Biotechnologie und Biophysik, Biozentrum, Universität Würzburg, +49 931 31-88687, m.sauer@uni-wuerzburg.de
Dr. Gerti Beliu, Rudolf Virchow Center - Center for Integrative and Translational Bioimaging, Universität Würzburg, +49 931 31-89733, gerti.beliu@uni-wuerzburg.de