Chlamydien: Wie Bakterien das Ruder übernehmen
28.03.2017Damit Chlamydien in menschlichen Zellen überleben können, müssen sie jede Menge Tricks anwenden. Forscher der Uni Würzburg haben jetzt neue Mechanismen entdeckt.
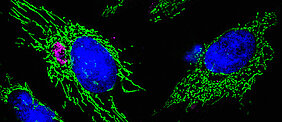
Wenn das Bakterium Chlamydia trachomatis eine menschliche Zelle befällt, steht es vor einer großen Aufgabe: Es muss verhindern, dass die Zelle Abwehrreaktionen oder den programmierten Zelltod einleitet und damit die Vermehrung und Verbreitung der Krankheitserreger im Körper stoppt. Weil ihm außerdem zahlreiche Stoffwechselprozesse fehlen oder nur in Bruchstücken vorhanden sind, ist es darauf angewiesen, dass es von der Wirtszelle mit den notwendigen Nährstoffen dauerhaft versorgt wird.
Wie es das Bakterium schafft, von der Zelle unerkannt zu bleiben und diese am Leben zu erhalten und für sich arbeiten zu lassen, steht im Mittelpunkt weltweiter Forschungsprojekte. Wissenschaftler der Universität Würzburg haben jetzt neue Details dieser Prozesse entschlüsselt. Die Forscher konnten Mechanismen aufzeigen, durch welche Chlamydia trachomatis bestimmte Proteine in der Zelle anreichert oder auf die Energielieferanten der Zelle, die Mitochondrien, einwirkt und damit die Zellen am Selbstmord hindert. Diese Mechanismen sind außerdem wichtig um die Bakterien vor der Erkennung des zelleigenen Abwehrsystems zu schützen. Die Ergebnisse ihrer Arbeit stellen die Forscher in der aktuellen Ausgabe der Fachzeitschriften Journal of Cell Biology sowie eLife vor.
Die Rolle der Mitochondrien
Verantwortlich für diese Studie war Professor Thomas Rudel, Inhaber des Lehrstuhls für Mikrobiologie an der Universität Würzburg. Rudel und seine Mitarbeiter konnten bereits vor drei Jahren zeigen, dass Chlamydien in den von ihnen befallenen Zellen das Tumorsupressor-Protein p53 außer Kraft setzen und einen Prozess starten, in dessen Folge Schäden am Erbgut repariert werden, die eine Folge der Chlamydien-Infektion sind. Mit der Blockade von p53 verhindern die Bakterien, dass die Zelle sich im Extremfall selbst außer Gefecht setzt; sie gewinnen so Zeit für die eigene Vermehrung.
In ihrer neuen Studie haben die Mikrobiologen einen genaueren Blick auf die Mitochondrien geworfen. „Mitochondrien spielen eine wichtige Rolle bei der Energieversorgung und dem programmierten Zelltod“, erklärt Thomas Rudel. Viel spreche dafür, dass Veränderungen in ihrer Architektur und Dynamik in einem engen Zusammenhang mit den allgemeinen Stoffwechselvorgängen der Zelle stünden.
Kleine RNA-Moleküle im Fokus
Welche Auswirkungen hat eine Infektion mit Chlamydien auf Mitochondrien? Um diese Frage zu klären, hat Rudels Team einen weiteren Akteur in dem Zellgeschehen genauer unter die Lupe genommen: sogenannte miRNAs oder MicroRNAs. Diese kleinen RNA-Moleküle steuern wichtige Lebensvorgänge innerhalb von Zellen, indem sie komplexe Gennetzwerke regulieren.
Mit Hilfe der Hochdurchsatz-Technik haben Rudel und seine Mitarbeiter detailliert untersucht, wie sich eine Chlamydien-Infektion auf die miRNA-Expression der befallenen Zelle auswirkt. Auffälligstes Merkmal dabei: eine stark vermehrte Bildung der MicroRNA miR-30c-5p. Eine hohe Konzentration dieser kleinen RNA-Moleküle ist für die Bakterien von Vorteil: „Sie sorgen dafür, dass das Tumorsupressor-Protein dauerhaft herunterreguliert wird“, erklärt Thomas Rudel.
Im Gegenzug macht eine Blockade von miR-30c den Chlamydien zu schaffen. Dann nämlich steigert die Zelle die Produktion eines Proteins namens Drp1, das die Mitochondrien in gestressten Zellen fragmentiert. Steigt dessen Konzentration im Zellinneren, erhöht sich die stressbedingte Teilungsrate der Mitochondrien, gleichzeitig steigt die Chance für die befallene Zelle, den Bakterienangriff zu überleben. Denn die Chlamydien sind in ihrem Wachstum deutlich gebremst, weil fragmentierte Mitochondrien den Erregern weniger Energie liefern und die Bakterien so verhungern.
Täuschungsmanöver schützt vor Müllabfuhr
Die Versorgung mit ausreichender Nahrung reicht für das Überleben in der Zelle nicht aus, auch die effektiven Abwehrsysteme der Zellen müssen von den Bakterien abgeschaltet werden. Hierzu blockieren sie das Selbstmordprogramm der Zelle, das infizierte Zellen aktivieren, um sich selbst und damit auch die Erreger zu zerstören. Eine zweite, sehr effiziente Strategie der Zelle besteht darin, die unerwünschten Eindringlinge als „Abfall“ zu deklarieren und in der zelleigenen Müllverwertung, dem Proteasom, zu entsorgen.
Alle zellulären Proteine durchlaufen ständig einen Kreislauf von Proteinabbau und Neusynthese. Ein abzubauendes Protein wird mit einer Art Etikett, einem sogenannten Ubiquitin, markiert und anschließend im Proteasom abgebaut. Nicht nur Proteine, sondern auch komplexere zelluläre Strukturen oder ganze Bakterien können mittels Ubiquitinierung für deren Abbau markiert werden. Diesen Vorgang kann die Zelle auch mithilfe von Spezialwerkzeugen, den sogenannte Deubiquitinasen rückgängig machen; Entfernen des Ubiquitins verhindert den Abbau.
Das Team von Thomas Rudel konnte jetzt zeigen, dass Chlamydien selbst eine Deubiquitinase namens Cdu1 in die Wirtszelle einschleusen, mit drastischen Folgen: „Es ist schon verrückt – Bakterien haben gar kein Ubiquitinsystem und verstehen es doch, gezielt diesen ausgeklügelten Abwehr-Code der Zelle so zu ändern, dass die Zelle die Bakterien nicht mehr als Eindringlinge erkennt.“
Cdu1 entfernt einfach die Ubiquitine von den Bakterien selbst und von einem wichtigen Regulator, der das Zelltodprogramm aus Kraft setzt. Somit entgehen die Bakterien ihrer Vernichtung und die Zelle „muss“ weiterleben, um die Erreger zu versorgen.
Chlamydien: Trickreiche Invasoren
Bakterien vom Stamm Chlamydia trachomatis sind beim Menschen für eine Reihe schwerer Krankheiten verantwortlich. So zählt eine Chlamydien-Infektion zu den häufigsten sexuell übertragbaren Erkrankungen der Welt. Aktuelle Schätzungen gehen davon aus, dass weltweit je nach Altersgruppe bis zu zehn Prozent der Bevölkerung mit den Erregern infiziert sind.
Ohne Behandlung verursachen die Bakterien bei Frauen häufig eine Verklebung der Eileiter, was Eileiterschwangerschaften oder Unfruchtbarkeit zur Folge haben kann. Neuere Befunde belegen sogar, dass Chlamydien-Infektionen die Entstehung von Eierstockkrebs fördern. Männer können nach einer Infektion zeugungsunfähig werden.
Eine weitere Folge einer Chlamydien-Infektion tritt vor allem in tropischen Ländern auf: Dort befallen die Bakterien die Augen und können zur Erblindung führen. Rund 150 Millionen Menschen sollen daran erkrankt sein. Andere Stämme können Lungenentzündungen auslösen und stehen im Verdacht, Krankheiten wie beispielsweise Arterienverkalkung und Alzheimer zu verursachen.
Chlamydia preserves the mitochondrial network necessary for replication via microRNA-dependent inhibition of fission. Suvagata Roy Chowdhury, Anastasija Reimer, Malvika Sharan, Vera Kozjak‑Pavlovic, Ana Eulalio, Bhupesh K. Prusty, Martin Fraunholz, Karthika Karunakaran, and Thomas Rudel The Journal or Cell Biology. https://doi.org/10.1083/jcb.201608063
Chlamydia trachomatis-containing vacuole serves as deubiquitination platform to stabilize Mcl-1 and to interfere with host defense. Annette Fischer, Kelly S Harrison, Yesid Ramirez, Daniela Auer, Suvagata Roy Chowdhury, Bhupesh K Prusty, Florian Sauer, Zoe Dimond, Caroline Kisker, P Scott Hefty and Thomas Rudel. eLife. http://dx.doi.org/10.7554/eLife.21465.001
Kontakt
Prof. Dr. Thomas Rudel, Lehrstuhl für Mikrobiologie, T (0931) 31-84401, Thomas.Rudel@biozentrum.uni-wuerzburg.de