Bewegung drosselt Insulin-Produktion
04.01.2023Fängt eine Fruchtfliege an zu laufen oder zu fliegen, werden ihre Insulin-produzierenden Zellen sofort gehemmt. Das könnte eine Erklärung dafür sein, warum Bewegung die Gesundheit fördert.
Insulin ist für den Menschen und viele andere Lebewesen ein essenzielles Hormon. Seine wohl bekannteste Aufgabe ist es, den Zuckerstoffwechsel zu regulieren. Wie es diesen Job erledigt, ist gut erforscht. Weitaus weniger ist darüber bekannt, wie die Aktivität der Insulin-produzierenden Zellen und folglich die Ausschüttung von Insulin kontrolliert wird.
Neuigkeiten zu dieser Frage stellt ein Team aus dem Biozentrum der Julius-Maximilians-Universität (JMU) Würzburg jetzt im Fachjournal Current Biology vor. Als Untersuchungsobjekt verwendete die Gruppe von Dr. Jan Ache die Fruchtfliege Drosophila melanogaster. Denn interessanterweise schüttet auch diese Fliege nach einer Mahlzeit Insulin aus – bei ihr kommt das Hormon aber nicht aus der Bauchspeicheldrüse wie beim Menschen, sondern aus Nervenzellen im Gehirn.
Elektrophysiologische Messungen bei aktiven Fliegen
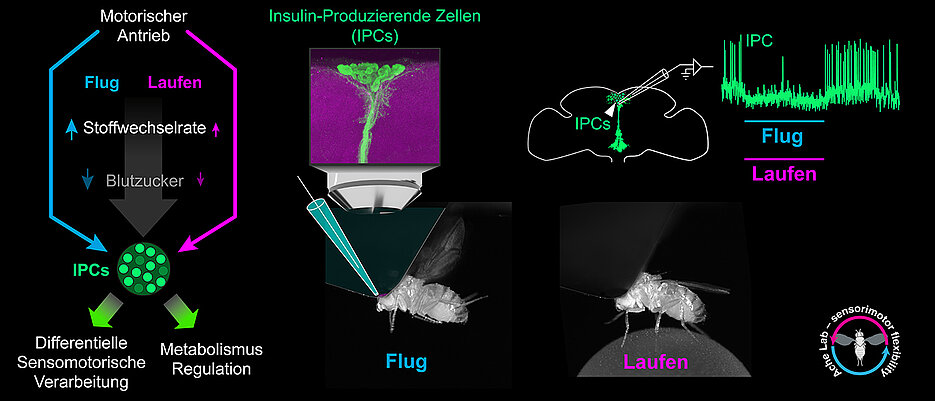
Die JMU-Gruppe hat herausgefunden, dass sich eine körperliche Aktivität der Fliege stark auf deren Insulin-produzierende Zellen auswirkt. Erstmals haben die Forscherinnen und Forscher dafür die Aktivität dieser Zellen elektrophysiologisch bei laufenden oder fliegenden Drosophila gemessen.
Ergebnis: Wenn Drosophila anfängt zu laufen oder zu fliegen, werden ihre Insulin-produzierenden Zellen sehr schnell gehemmt. Beendet die Fliege ihre Bewegungen, steigt die Aktivität der Zellen sofort wieder an und schießt zeitweise sogar über den Normalwert hinaus.
„Wir nehmen an, dass die geringe Aktivität der Insulin-produzierenden Zellen während der Bewegung zur Bereitstellung von Zucker beiträgt, um den erhöhten Energiebedarf zu decken“, sagt Dr. Sander Liessem, Erstautor der Publikation. „Und wir vermuten, dass die erhöhte Aktivität nach der Beendigung der Bewegung dazu beiträgt, die Energiespeicher der Fliege wieder aufzufüllen, zum Beispiel in den Muskeln.“
Blutzucker spielt bei der Regulation keine Rolle
Das JMU-Team konnte außerdem nachweisen: Die sehr schnelle verhaltensabhängige Hemmung der Insulin-produzierenden Zellen wird aktiv von Nervenbahnen gesteuert. „Sie ist weitgehend unabhängig von Änderungen der Zuckerkonzentration im Blut der Tiere“, erklärt Mitautorin Dr. Martina Held.
Es mache für den Organismus sehr viel Sinn, auf diese Weise einen steigenden Energiebedarf vorherzusehen, um extremen Schwankungen des Blutzuckerspiegels vorzubeugen.
Insulin hat sich in der Evolution kaum verändert
Lassen die Ergebnisse Rückschlüsse auf den Menschen zu? Vermutlich ja.
„Zwar erfolgt die Ausschüttung von Insulin in Fruchtfliegen über andere Zellen als beim Menschen, aber das Insulin-Molekül und seine Funktion haben sich im Lauf der Evolution kaum verändert“, sagt Jan Ache. Und in den vergangenen 20 Jahren seien mit Drosophila als Modellorganismus schon viele grundlegende Fragen beantwortet worden, die auch zu einem besseren Verständnis von Stoffwechseldefekten beim Menschen und damit einhergehenden Krankheitsbildern wie Diabetes oder Fettleibigkeit beitragen könnten.
Weniger Insulin bedeutet Langlebigkeit
„Ein spannender Punkt ist, dass eine reduzierte Insulinaktivität zum gesunden Altern und zur Langlebigkeit beiträgt“, erzählt Sander Liessem. Das sei bereits bei Fliegen, Mäusen, Menschen und anderen Arten nachgewiesen worden. Dasselbe gelte für einen aktiven Lebensstil. „Unsere Arbeit zeigt hier einen möglichen Zusammenhang, wie sich körperliche Aktivität über neuronale Signalwege positiv auf die Insulinregulierung auswirken könnte.“
Weitere Schritte in der Forschung
Als nächstes will Jan Aches Team untersuchen, welche Botenstoffe und Schaltkreise des Nervensystems bei der Fliege für die Aktivitätsänderung der Insulin-produzierenden Zellen verantwortlich sind. Das dürfte herausfordernd werden: An Vorgängen der Neuromodulation sind meistens mehrere Botenstoffe beteiligt, und die einzelnen Stoffe können in Kombination entgegengesetzte oder sich ergänzende Effekte haben.
Die Gruppe analysiert nun die mannigfaltigen Wege, auf denen Insulin-produzierende Zellen Input von außen bekommen. Außerdem untersucht sie weitere Faktoren, die einen Einfluss auf die Aktivität dieser Zellen haben könnten, zum Beispiel das Alter der Fliegen oder deren Ernährungszustand.
„Parallel dazu erforschen wir die neuronale Kontrolle des Laufverhaltens“, erklärt Jan Ache. Das langfristige Ziel seiner Gruppe sei es, diese beiden Forschungsfragen zusammenzuführen: Wie kontrolliert das Gehirn Laufen und andere Verhaltensweisen, und wie wird dabei sichergestellt, dass der Energiehaushalt entsprechend reguliert wird?
Publikation
Behavioral state-dependent modulation of Insulin-Producing Cells in Drosophila. Sander Liessem, Martina Held, Rituja S. Bisen, Hannah Haberkern, Haluk Lacin, Till Bockemühl, Jan M. Ache. Current Biology, online publiziert am 28. Dezember 2022, https://doi.org/10.1016/j.cub.2022.12.005
Kontakt
Dr. Jan M. Ache, Lehrstuhl für Neurobiologie und Genetik, Biozentrum der Universität Würzburg, T +49 931 31-88577, jan.ache@uni-wuerzburg.de
Förderung
Die Deutsche Forschungsgemeinschaft (DFG) unterstützt Jan Aches Gruppe im Rahmen des Emmy-Noether- und des Neuronex-Programms. Beide Förderinstrumente haben signifikant zum Erfolg dieser Arbeit beigetragen.