Was Pflanzen elektrisch erregbar macht
08.03.2022Beim Menschen sind nur Nerven und Muskelzellen elektrisch erregbar, bei Pflanzen dagegen fast alle Zellen. Das liegt an einem ausgeklügelten Schaltmechanismus in einem Ionenkanal der Vakuole.
Pflanzenzellen nutzen elektrische Signale zur Verarbeitung und Weitergabe von Informationen. Als Postdoc von Erwin Neher in Göttingen hat der Biophysiker Rainer Hedrich 1987 mit Hilfe der Patch-Clamp-Technik (Nobelpreis für Neher und Sakmann 1991) einen Ionenkanal in der Zentralvakuole der Pflanzenzelle entdeckt, der durch Kalzium und elektrische Spannung aktiviert wird.
2019 identifizierte Hedrichs Team an der Julius-Maximilians-Universität Würzburg (JMU) diesen TPC1-Kanal als ein wichtiges Element für die elektrische Kommunikation in Pflanzen. Fällt der Kanal aus, ist die Signalweitergabe verlangsamt. Ist er hyperaktiv, also zu lange geöffnet, ist die Pflanze hochgradig gestresst und hat Probleme zu wachsen.
Diese Reaktionen verdeutlichen: Pflanzen müssen die Öffnungszeit des Ionenkanals TPC1 streng kontrollieren, damit die elektrische Kommunikation zwischen ihren Zellen reibungsfrei abläuft.
Die Struktur erklärt, wie der Kanal angeschaltet wird
Eine Publikation im Journal PNAS (Proceedings der Nationalen Akademie der Wissenschaften der USA) liefert nun neue Einsichten in die molekulare Arbeitsweise und Regulation des TPC1-Kanals. Das gelang durch den Zusammenschluss zweier Fachkompetenzen: Für die Pflanzen-Biophysik war ein JMU-Team um Rainer Hedrich und Irene Marten zuständig, für die Strukturbiologie eine Gruppe um Robert M. Stroud und Sasha Dickinson von der University of California in San Francisco.
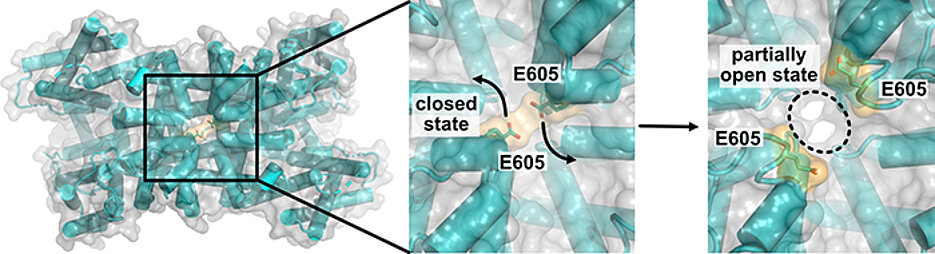
Das US-Team belegt mit hochaufgelösten kryo-elektronenmikroskopischen Bildern sehr anschaulich, dass es vor der Öffnung des Kanals zu massiven Konformationsänderungen mehrerer Protein-Domänen kommt. Ein elektrischer Reiz initiiert eine rotierende Bewegung der Spannungssensor-Domäne. Dabei klappen Aminosäurereste weg, die im vakuolären Eingangsbereich des Kanals als Bindungsstellen für hemmende Kalzium-Ionen dienen – so wird der Weg frei für den Ionenfluss.
Der vakuoläre Kalzium-Gehalt hält den Spannungssensor in Schach
Das Team um Hedrich und Marten konnte zeigen, dass der Kanal TPC1 angeschaltet wird, wenn auf Außenreize hin der Kalzium-Spiegel im Zellplasma ansteigt. Ein Anstieg der Kalzium-Spiegels in der Vakuole hingegen bremst einen überstarken Ionenfluss durch den Kanal und macht die Vakuolenmembran quasi für kalziumabhängige elektrische Reizungen unempfindlich.
Die neu entdeckte Bindungsstelle für vakuoläre Kalzium-Ionen in der ionenleitenden Pore des Kanals spielt dabei eine entscheidende Rolle.
„Die Funktion dieser Kanaldomäne konnten wir mit Patch-Clamp-Messungen aufklären“, sagt JMU-Professorin Irene Marten. „Bei einer Kalzium-Bindung an die vakuoläre Porenbindungsstelle kommt es zu einer negativen Rückkopplung mit dem Spannungssensor, das heißt die Bewegung der Spannungssensor-Domäne wird stark beeinträchtigt. Die Folge: der Kanal bleibt geschlossen und eine elektrische Erregung der Vakuole bleibt aus. Sind die Poren-Aminosäurereste dagegen aus dem Ionentransportweg weggeklappt, erfolgt keine vakuoläre Kalzium-Bindung und die Kanalöffnung wird stark erleichtert“.
Frage nach der Evolution der TPC1-Kanäle
Die Publikation in PNAS trägt weiter dazu bei, dass der pflanzliche Ionenkanal TPC1 heute zu den am besten verstandenen spannungsabhängigen Ionenkanälen gehört. Dieses Wissen kann dabei helfen, die TPC1-abhängigen Vorgänge auch in tierischen Zellen besser zu verstehen.
Was werden die Wissenschaftler als nächstes tun? „Wir gehen der Frage nach, ob die TPC1-Kanäle verschiedener Pflanzenarten sich hinsichtlich der Regulation und auch in anderen Eigenschaften unterscheiden und ob sich damit neue Anpassungsmöglichkeiten an die Umwelt eröffnen“, sagt Rainer Hedrich. „Hierbei berücksichtigen wir auch Regulatoren, die bei den tierischen TPC1-Kanälen eine Rolle spielen. Die Studien sollen uns auch einen Einblick in die Evolution der TPC1-Kanäle liefern.“
Publikation
Molecular basis of multistep voltage activation in plant two-pore channel 1. PNAS, 24.02.2022, 119 (9) e2110936119 | Free Access: https://doi.org/10.1073/pnas.2110936119
Kontakt
Prof. Dr. Irene Marten, Lehrstuhl für Botanik I (Molekulare Pflanzenphysiologie und Biophysik), Universität Würzburg, T +49 931 31-86118, marten@botanik.uni-wuerzburg.de
Prof. Dr. Rainer Hedrich, Lehrstuhl für Botanik I (Molekulare Pflanzenphysiologie und Biophysik), Universität Würzburg, T +49 931 31-86100, hedrich@botanik.uni-wuerzburg.de