Balanceakt zwischen Erhalt und Zerstörung
13.09.2016Eine Forschergruppe des Uniklinikums Würzburg hat eine neue Behandlungsstrategie entwickelt, die das Potenzial hat, lebensbedrohliche Immunreaktionen nach einer Knochenmarktransplantation zu verhindern. Sie setzt dabei auf die Hilfe spezieller Immunzellen.
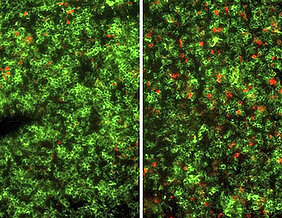
Im Kampf gegen bestimmte Leukämien und Lymphome ist eine Transplantation von Knochenmark heute gängige Therapie. Das Prinzip dahinter: Stammzellen aus dem Knochenmark entwickeln sich im Körper des Patienten zu Immunzellen, die in der Lage sind, die Krebszellen des Patienten effizient zu töten. Allerdings kann es passieren, dass die vom Knochenmarkspender abstammenden Immunzellen auch gesunde Organe des Empfängers attackieren. Diese Immunreaktion kann zu lebensbedrohlichen Symptomen führen, die sich in der sogenannten akuten Graft-versus-Host-Erkrankung manifestieren.
Neues Protein hilft, T-Zellen im Patienten zu vermehren
Eine Möglichkeit, dies zu verhindern, ist es, gleichzeitig sehr viele regulatorische T-Zellen – sogenannte Tregs – mit zu transplantieren. Tregs sind spezialisierte Immunzellen, die Immuneffektorzellen unterdrücken können und so eine Balance zwischen der Erhaltung der gesunden Organe und der Zerstörung von Krebszellen herstellen. „Die Transplantation von Tregs ist allerdings bislang eine große Herausforderung, weil diese Zellen erst aus dem Blut von geeigneten Spendern isoliert und anschließend im Labor aufwändig kultiviert werden müssen“, berichtet Professor Andreas Beilhack, der eine Forschergruppe für Experimentelle Stammzelltransplantation am Uniklinikum Würzburg (UKW) leitet.
Ein von ihm und Professor Harald Wajant, Abteilungsleiter für Molekulare Innere Medizin des UKW, geführtes Forschungsteam hat nun, vorerst im Mausmodell, eine vielversprechende Alternative entwickelt, um die komplexe Kultur von Tregs im Labor zu umgehen. Die Wissenschaftler designten ein neues Protein mit Namen STAR2, das es erlaubt, die Vermehrung der Tregs direkt im Körper des Empfängers zu stimulieren. Mäuse, die mit STAR2 vorbehandelt wurden, wiesen nicht nur eine höhere Zahl an Tregs auf, sondern waren auch vor der Graft-versus-Host-Erkrankung nach einer Stammzelltransplantation geschützt. Gleichzeitig blieb die Fähigkeit der Spenderimmunzellen erhalten, Krebszellen zu vernichten.
Potenzial auch für andere Entzündungserkrankungen
STAR2 wirkt durch Bindung eines Rezeptors an der Zelloberfläche von Tregs. Die Wissenschaftler fanden auch heraus, dass eine humane STAR2-Variante ähnliche Effekte auf menschliche Tregs hat. „Unsere Ergebnisse legen nahe, dass die neue Strategie auch bei Leukämie- und Lymphompatienten funktionieren kann“, sagt Andreas Beilhack. Darüber hinaus könne dieselbe Strategie auch bei einigen anderen Entzündungserkrankungen helfen, da „die Tregs auch bei Autoimmunerkrankungen und der soliden Organtransplantation als ‚Schiedsrichter‘ zur Erhaltung einer idealen Balance von Immunreaktionen eine wichtige Rolle spielen“, so Beilhack.
In der aktuellen Ausgabe der Zeitschrift Journal of Experimental Medicine stellen die Wissenschaftler ihre Arbeit vor.
Chopra, M., et al. Exogenous TNFR2 activation protects from acute GvHD via host T reg cell expansion. J. Exp. Med. 213:1881–1900, 2016. doi: 10.1084/jem.20151563