Entschlüsselt: Wie Krebszellen sich vor dem Immunsystem schützen
22.01.2026Das Krebsgen MYC tarnt Tumoren, indem es Alarmsignale unterdrückt, die normalerweise das Immunsystem aktivieren. Dieses Ergebnis einer neuen Studie bietet einen vielversprechenden Ansatz für die Entwicklung neuer Therapien.
Könnte dies einen Wandel in unserer Sichtweise auf die Krebstherapie bedeuten? Zumindest im Labor deuten die Ergebnisse darauf hin. Einem internationalen Forscherteam ist es gelungen, einen wichtigen Mechanismus zu entschlüsseln, der das Wachstum von Bauchspeicheldrüsenkrebs steuert. Die Wissenschaftlerinnen und Wissenschaftler identifizierten einen möglicherweise zentralen Mechanismus, mit dem sich Krebszellen vor Angriffen des körpereigenen Immunsystems schützen. Die Blockade dieses Mechanismus führte zu einer dramatischen Verringerung der Tumore bei Labortieren.
Blick auf den zentralen Motor der Zellteilung
Die Ergebnisse der Studie wurden jetzt in der Fachzeitschrift Cell veröffentlicht. Die Forschung wurde in erster Linie von Leonie Uhl, Amel Aziba und Sinah Löbbert zusammen mit weiteren Teams der Julius-Maximilians-Universität Würzburg (JMU), des Massachusetts Institute of Technology (USA) und des Universitätsklinikums Würzburg durchgeführt.
Geleitet hat die Studie Martin Eilers, Inhaber des Lehrstuhls für Biochemie und Molekularbiologie an der JMU, als Teil des Cancer Grand Challenges KOODAC-Teams. Das Projekt wurde teilweise von Cancer Research UK, der Kinderkrebsstiftung (Kika) und dem französischen Nationalen Krebsinstitut (INCa) im Rahmen der Initiative Cancer Grand Challenges finanziert. Weitere Mittel stammen aus einem Advanced Grant des Europäischen Forschungsrats, der Martin Eilers bewilligt wurde.
In ihrer Studie haben sich die Forschenden auf ein spezielles Protein konzentriert, das in der Krebsforschung seit langem bekannt ist: das Onkoprotein MYC. „Dieses Protein ist in vielen Tumorarten einer der zentralen Motoren der Zellteilung und damit des unkontrollierten Wachstums der Tumoren“, erklärt Martin Eilers. Doch eine entscheidende Frage blieb bisher unbeantwortet: Wie gelingt es Tumoren mit hoher MYC-Aktivität, die körpereigene Immunabwehr zu umgehen? Denn obwohl MYC-getriebene Tumore sehr schnell wachsen, bleiben sie für das Immunsystem oft unsichtbar.
Ein zweites Gesicht des Krebsgens
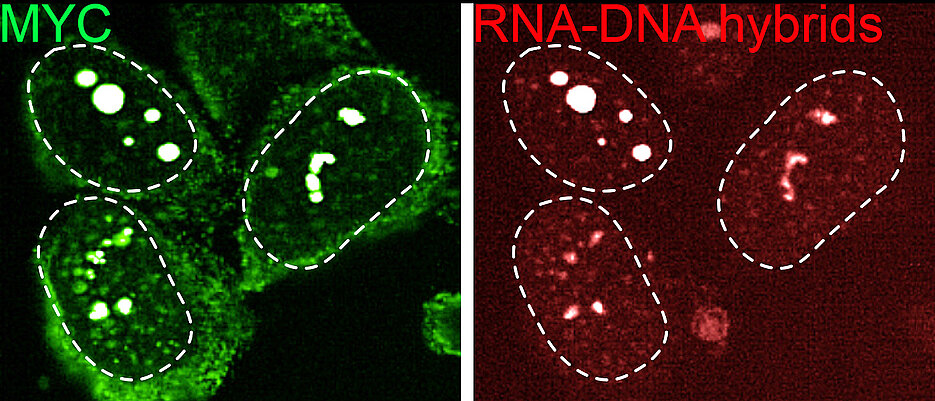
Die Antwort auf diese Frage liefert die jetzt veröffentlichte Studie. Die zentrale Entdeckung des internationalen Forschungsteams ist, dass MYC eine Doppelfunktion besitzt. Neben seiner bekannten Rolle, an DNA zu binden und wachstumsfördernde Gene zu aktivieren, kann es seine Aufgabe wechseln, wenn die Zelle unter Stress steht. Unter den chaotischen Bedingungen, die in schnell wachsenden Tumoren herrschen, übernimmt MYC eine neue Funktion: Statt an DNA bindet es dann an neu entstehende RNA-Moleküle.
Diese Bindung an RNA hat weitreichende Konsequenzen: Mehrere MYC-Proteine bilden dichte Cluster, sogenannte Multimere, die wie molekulare Kondensate funktionieren. Diese „Tröpfchen“ wirken als Sammelstellen, die gezielt andere Proteine – insbesondere den Exosom-Komplex – anziehen und an einem Ort konzentrieren.
Der Exosom-Komplex baut dann sehr gezielt zelluläre Abfallprodukte ab – in erster Linie sogenannte RNA-DNA-Hybride. Diese sind Fehlprodukte der Gen-Aktivität und wirken im Zellinneren normalerweise wie ein lautes Alarmsignal, das dem Immunsystem meldet: Hier stimmt etwas nicht.
Wie MYC das Immunsystem austrickst
Genau hier setzt die Tarnfunktion von MYC an. Indem es mit Hilfe der Exosom-Komplexe den Abbau der RNA-DNA-Hybride organisiert, beseitigt es die Alarmsignale, bevor diese die Immunabwehr aktivieren können. Die nachgeschaltete Signalkette kommt dadurch gar nicht erst in Gang. Der Tumor bleibt für die Immunzellen unsichtbar.
Die Forschenden konnten nachweisen, dass eine ganz bestimmte RNA-Bindungsregion innerhalb des MYC-Proteins für diese Tarnung verantwortlich ist. Entscheidend ist dabei, dass diese Region für die wachstumsfördernde Funktion von MYC, also seine Fähigkeit zur DNA-Bindung, nicht benötigt wird. Die beiden Funktionen – Wachstum antreiben und Immunsystem täuschen – sind mechanistisch voneinander getrennt.
Ein gezielter Schlag gegen den Tumor im Tiermodell
Damit war der nächste Schritt klar: MYC-Proteine mit einer genetisch veränderten RNA-Binderegion sollten nicht mehr in der Lage sein, das Exosom zur Hilfe zu rufen und den Alarmweg zu blockieren. Tatsächlich zeigten sich die Konsequenzen dieser Entdeckung in den entsprechenden Experimenten im Tiermodell dramatisch: „Während Pankreaskarzinome mit normalem MYC ihre Größe innerhalb von 28 Tagen um das 24-fache steigerten, kollabierten Tumore mit einem defekten MYC-Protein im selben Zeitraum und schrumpften um 94 Prozent – dies aber nur, wenn das Immunsystem der Tiere intakt war“, beschreibt Martin Eilers das zentrale Ergebnis der Studie.
Ausblick und therapeutisches Potenzial
Diese Ergebnisse eröffnen vielversprechende neue Wege für die Krebstherapie. Bisherige Versuche, MYC vollständig zu blockieren, erwiesen sich als schwierig, da das Protein auch für gesunde Zellen wichtig ist. Der neu entdeckte Mechanismus bietet nun eine deutlich spezifischere Angriffsfläche.
„Anstatt MYC komplett auszuschalten, könnten zukünftige Medikamente gezielt nur seine Fähigkeit zur RNA-Bindung hemmen. Dies würde die wachstumsfördernde Funktion möglicherweise unberührt lassen, aber die Tarnkappe des Tumors lüften“, erklärt Eilers. Der Tumor würde so für das Immunsystem wieder sichtbar und angreifbar.
Bis eine entsprechende Therapie für den Menschen marktreif ist, ist es jedoch noch ein weiter Weg, warnt der Wissenschaftler. In einem nächsten Schritt müsse zunächst geklärt werden, wie genau die immunstimulierenden RNA-DNA-Hybride aus dem Zellkern transportiert werden und wie die RNA-Bindung von MYC die unmittelbare Umgebung des Tumors beeinflusst.
Dr. David Scott, Direktor von Cancer Grand Challenges, kommentierte die Studie wie folgt: „Cancer Grand Challenges unterstützt internationale Teams wie KOODAC, die die Grenzen unseres Wissens über Krebs erweitern. Forschungen wie diese zeigen, wie das Entschlüsseln der Mechanismen, mit denen Tumore sich vor dem Immunsystem verstecken, neue Möglichkeiten eröffnen kann, nicht nur für Krebserkrankungen bei Erwachsenen, sondern auch für Krebserkrankungen bei Kindern, auf die sich das KOODAC-Team konzentriert. Es ist ein ermutigendes Beispiel dafür, wie internationale Zusammenarbeit und vielfältiges Fachwissen dazu beitragen können, einige der schwierigsten Herausforderungen in der Krebsforschung zu bewältigen.“
Originalpublikation
Uhl et al. "MYC binding to nascent RNA suppresses innate immune signaling by R-loop-derived RNA-DNA hybrids." Cell, 22. Januar 2026, DOI: 10.1016/j.cell.2025.12.019
Kontakt
Prof. Dr. Martin Eilers, Universität Würzburg, Lehrstuhl für Biochemie und Molekularbiologie
T +49 931 31-84111, martin.eilers@uni-wuerzburg.de
Cancer Grand Challenges
Cancer Grand Challenges wurde 2020 von zwei der weltweit größten Förder-Einrichtungen der Krebsforschung gegründet: Cancer Research UK und dem National Cancer Institute. Die Organisation unterstützt eine globale Gemeinschaft vielfältiger, erstklassiger Forschungsteams dabei, sich zusammenzuschließen, neue Denkansätze zu entwickeln und einige der schwierigsten Herausforderungen im Kampf gegen Krebs anzugehen. Dabei handelt es sich um Hindernisse, die den Fortschritt weiterhin behindern und die kein Wissenschaftler, keine Institution und kein Land allein bewältigen kann.
Mit Fördermitteln von bis zu 20 Millionen britische Pfund – umgerechnet rund 23 Millionen Euro – sind die Teams von Cancer Grand Challenges in der Lage, die traditionellen Grenzen von Geografie und Disziplin zu überwinden, um die dringend benötigten Fortschritte im Kampf gegen Krebs zu erzielen.
Cancer Grand Challenges finanziert internationale Teams, darunter KOODAC, das gemeinsam von Professor Martin Eilers und Professor Yaël Mossé geleitet wird. Das KOODAC-Team wurde 2024 gegründet, um solide Tumoren bei Kindern zu bekämpfen, und entwickelt innovative Methoden, um die Proteine anzugreifen, die das Tumorwachstum vorantreiben. Diese Studie konzentrierte sich zwar auf Bauchspeicheldrüsenkrebs, aber die Ergebnisse werden vom KOODAC-Team genutzt, um potenzielle neue Behandlungsmethoden für MYC-bedingte Krebserkrankungen bei Kindern zu entwickeln.