Organoid-Modelle für den Gebärmutterhals
19.01.2021Wie entstehen Tumoren am Gebärmutterhals? Zu dieser Frage sind jetzt viele neue Details bekannt. Zu verdanken ist das auch Dr. Cindrilla Chumduri vom Biozentrum.
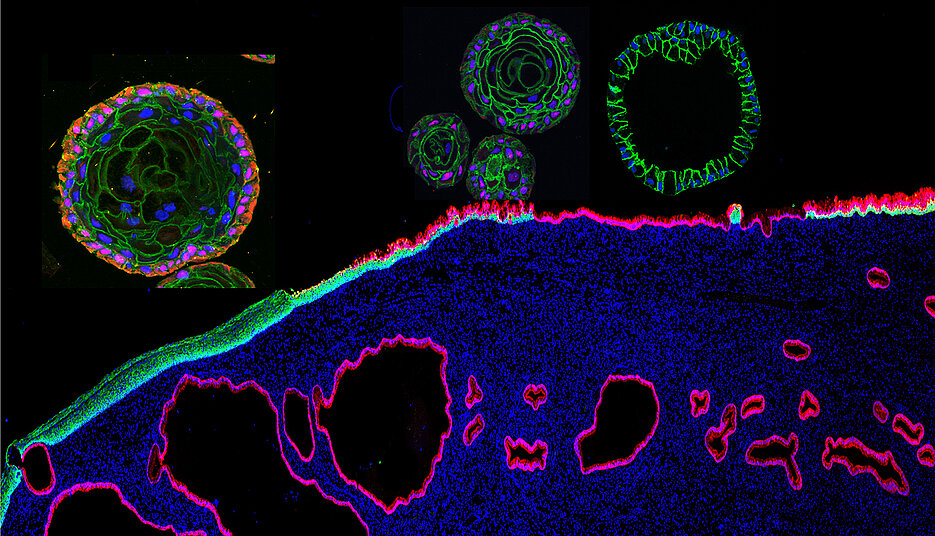
In der biomedizinischen Forschung werden zunehmend Organoide eingesetzt. Das sind im Labor hergestellte organähnliche Strukturen, die nur wenige Millimeter groß sind. Mit Organoiden lassen sich Lebensvorgänge und die Wirkung von Medikamenten untersuchen. Da sie echten Organen sehr ähnlich sind, bieten sie einige Vorteile gegenüber anderen Zellkulturen.
Es gibt auch Organoid-Modelle, die für den Gebärmutterhals entwickelt wurden. Dieser Teil des weiblichen Körpers ist besonders von Krebserkrankungen gefährdet. Durch die Schaffung neuartiger Organoid-Modelle hat eine Forschungsgruppe um Cindrilla Chumduri (Würzburg), Rajendra Kumar Gurumurthy (Berlin) und Thomas F. Meyer (Kiel) nun einen einzigartigen Ansatz etabliert, um die Biologie des Gebärmutterhalses zu studieren und wichtige Meilensteine der Krebsentwicklung zu identifizieren.
Die Ergebnisse sind in der Zeitschrift Nature Cell Biology veröffentlicht. Die Forschungsgruppe nutzte die Organoide, um Stammzellen des gesunden Gebärmutterhalses und die Veränderungen zu identifizieren, die bei der Metaplasie auftreten. Das ist ein frühes Stadium der Krebsentstehung.
Wie Vorstufen von Krebszellen entstehen
Der Gebärmutterhals besteht aus zwei Regionen, die von unterschiedlichen Zellschichten, sogenannten Epithelien, bedeckt sind: von mehrschichtigen Plattenepithelien und von einschichtigen Säulenepithelien. Beide Typen gehen an bestimmten Stellen ineinander über. Diese Übergangszonen sind Hotspots für die infektionsbedingte Krebsentwicklung.
Eine wichtige Krebsvorstufe an diesen Stellen ist das Auftreten von Metaplasien. Bei diesem Prozess wird das angestammte Epithel von dem anderen Epithel ersetzt. Das Forschungsteam hat nun aufgeklärt, wie diese metaplastischen Zellen entstehen und wie sie reguliert werden.
Zum ersten Mal hat das Team einen kompletten Zellatlas des Gebärmutterhalses erstellt. Es entdeckte, dass die Platten- und die Säulenepithelien an der zervikalen Übergangszone aus zwei unterschiedlichen Stammzelltypen entstehen. Die Regeneration der beiden Epithellinien und deren Aufrechterhaltung in der Übergangszone werden durch entgegengesetzte Signale aus den darunterliegenden Zellschichten gesteuert.
Die Forschungsgruppe zeigte auch, wie ruhende Stammzellen aktiviert werden, sich zu einer Plattenepithel-Metaplasie entwickeln und das angestammte Säulen-Epithel ersetzen. Sie zeigten unter anderem, dass Adenokarzinome und Plattenepithelkarzinome aus unterschiedlichen Stammzelllinien entstehen.
Ihre bahnbrechende und umfassende Studie liefert entscheidende Einblicke in die Biologie des Gebärmutterhalses und in den Übergang von gesundem Gewebe zur Krebsvorstufe.
Forschung an krebsauslösenden Viren und Bakterien
„Diese grundlegenden Erkenntnisse bilden eine Basis für das weitere Verständnis der Mechanismen, die an der Krebsentstehung an den metaplastischen Stellen beteiligt sind. Als nächstes wollen wir untersuchen, wie humane Papillomviren (HPV) zusammen mit überlagernden bakteriellen Infektionen eine Schlüsselrolle bei der Umwandlung von gesunden in bösartige Zellen spielen. Außerdem können unsere Erkenntnisse helfen, Diagnostika zur Früherkennung der beiden Tumorformen und neue therapeutische Strategien zu entwickeln“, sagt Dr. Cindrilla Chumduri.
Die Wissenschaftlerin leitet seit 2019 eine Forschungsgruppe an der Julius-Maximilians-Universität (JMU) Würzburg, angesiedelt am Biozentrum beim Lehrstuhl für Mikrobiologie. Zuvor forschte sie acht Jahre lang in Berlin, zunächst am Max-Planck-Institut für Infektionsbiologie, dann an der Charité Universitätsmedizin.
An der JMU hat die Forscherin ein hervorragendes Umfeld für ihre Arbeit gefunden. Ihr Forschungsschwerpunkt liegt auf den Wechselwirkungen zwischen krankheitserregenden Mikroben und dem Wirtsgewebe in verschiedenen Stadien der Krebsentwicklung. An der JMU nutzt Dr. Chumduri weiterhin organoide Modelle, um Mechanismen der durch Krankheitserreger ausgelösten Krebsentstehung zu entschlüsseln.
Publikation
Opposing Wnt signals regulate cervical squamocolumnar homeostasis and emergence of metaplasia, Nature Cell Biology, 18. Januar 2021, DOI: 10.1038/s41556-020-00619-0
Förderer
Die hier beschriebenen Forschungen wurden gefördert vom Bundesministerium für Bildung und Forschung (BMBF) im Infect-ERA-Project CINOCA sowie von der Deutschen Forschungsgemeinschaft (DFG) im Graduiertenkolleg 2157.
Kontakt
Dr. Cindrilla Chumduri, Lehrstuhl für Mikrobiology, Biozentrum,
Universität Würzburg, T +49 931 31-86531, cindrilla.chumduri@uni-wuerzburg.de