Enthemmung durch Zerfall
02.04.2019Forscher haben die krebsfördernden Enzyme USP25 und USP28 strukturbiologisch charakterisiert und signifikante Unterschiede identifiziert. Die Erkenntnisse könnten der Entwicklung neuer, nebenwirkungsarmer Krebsmedikamente dienen.
Das fortwährende Zusammenspiel aus Produktion und Abbau von Proteinen zählt zu den zentralen Steuerungskräften im Stoffwechsel der Zellen. Ein Kernmechanismus dabei ist die Markierung von Proteinen mit Ubiquitin, einem kleinen Molekül, das unter anderem als Signal für den Proteinabbau dient. Diese Markierung kann durch Enzyme aus der Gruppe der Deubiquitinasen rückgängig gemacht werden, wodurch das Protein gerettet wird.
Man vermutet, dass diese gegenläufigen Prozesse in Krebszellen aus dem Gleichgewicht geraten. Darum sind die Deubiquitinasen als vielversprechende Angriffspunkte für neue Krebstherapien in den Fokus der Wissenschaft gerückt.
Strukturen der katalytischen Domänen enträtselt
Eine Forschungsgruppe vom Rudolf-Virchow-Zentrum für experimentelle Biomedizin (RVZ) der Universität Würzburg hat sich speziell auf die zwei Deubiquitinasen USP25 und USP28 fokussiert. Beide sind wichtig für die Entwicklung verschiedener Tumore.
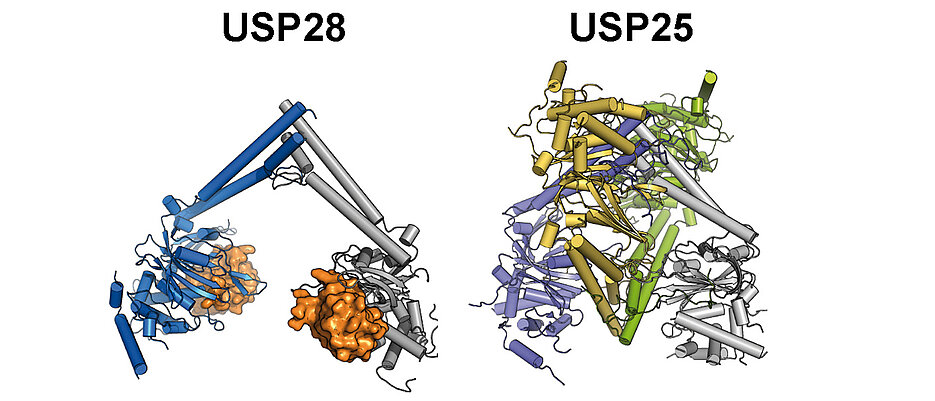
In der Fachzeitschrift „Molecular Cell“ liefern die Strukturbiologen Dr. Florian Sauer und Theresa Klemm aus der Arbeitsgruppe von Professorin Caroline Kisker nun wichtige Einblicke in die Struktur und Funktion der beiden Enzyme, die evolutionär nahe miteinander verwandt sind. Mittels Röntgenkristallographie wurden die dreidimensionalen Strukturen der zentralen katalytischen Domänen entschlüsselt. Dabei zeigten sich Gemeinsamkeiten, aber auch entscheidende Unterschiede.
Mutationen heben die Selbsthemmung auf
„Überraschende Erkenntnisse dabei waren, dass USP25 trotz seiner strukturellen Ähnlichkeit mit USP28 sowohl in isolierter Form als auch in Zellen inaktiv ist und dass es einen Zusammenhang zwischen dem oligomeren Zustand und seiner Aktivität gibt“, schildert Sauer.
Die Analysen zeigten, dass das inaktive USP25 einen aus vier Untereinheiten aufgebauten Molekülkomplex bildet, ein Tetramer. Das aktive USP28 hingegen liegt als Dimer vor, besteht also aus zwei identischen Untereinheiten.
„Durch das Einfügen von Mutationen, die in Krebszellen gefunden wurden, konnten wir zeigen, dass das USP25-Tetramer in zwei USP28-artige Dimere zerfällt. Das hebt die Selbsthemmung des Enzyms auf“, berichtet Klemm.
Neue Wegweiser für Krebsmedikamente
Dieses Wissen kann nun in die weitere Forschung über spezifisch wirksame und somit nebenwirkungsarme Krebsmedikamente einfließen.
„Zum einen wurden neue Ansatzpunkte erkannt, die beispielsweise dazu dienen können, maßgeschneiderte Wirkstoffe zu entwickeln, die nur USP28 adressieren und dabei das für die Immunantwort so wichtige USP25 aussparen“, sagt Sauer. „Zum anderen scheint es bei der Medikamentenentwicklung sinnvoll zu sein, auf eine Behinderung der Aktivierung des an sich inaktiven USP25 abzuzielen“, ergänzt Klemm.
Neben dem RVZ war die Abteilung für Klinische Tumorbiologie des Universitätsklinikums Tübingen an dieser Forschung beteiligt. Die Deutsche Forschungsgemeinschaft (DFG) förderte die Arbeiten über die Projekte „Targeting Therapeutic Windows in Essential Cellular Processes for Tumor Therapy“ (FOR 2314) und „Ubiquitylierung verstehen: Von molekularen Mechanismen zu Krankheiten“ (GRK 2243).
Pressemitteilung des Rudolf-Virchow-Zentrums
Publikation
Florian Sauer, Theresa Klemm, Ravi B. Kollampally, Ingrid Tessmer, Radhika K. Nair, Nikita Popov, Caroline Kisker: Differential Oligomerization of the Deubiquitinases USP25 and USP28 Regulates their Activities, Molecular Cell (2019), https://doi.org/10.1016/j.molcel.2019.02.029
Personen
Dr. Florian Sauer (Postdoktorand) und Theresa Klemm (Doktorandin) forschen in der Arbeitsgruppe von Prof. Dr. Caroline Kisker am Rudolf-Virchow-Zentrum für experimentelle Biomedizin der Julius-Maximilians-Universität Würzburg (JMU).
Prof. Dr. Caroline Kisker ist unter anderem Leiterin des Lehrstuhls für Strukturbiologie und Dekanin der Graduate School of Life Sciences der JMU. Seit April 2016 gehört sie zur Doppelspitze in der Leitung des Rudolf-Virchow-Zentrums für experimentelle Biomedizin.
Kontakt
Prof. Dr. Caroline Kisker, Rudolf-Virchow-Zentrum der Universität Würzburg, T +49 931 31-80381, caroline.kisker@virchow.uni-wuerzburg.de