„Briefverkehr“ zwischen Zellen wird streng reguliert
06.02.2018Tierische Zellen verschicken Membran-Bläschen, um miteinander zu kommunizieren. Würzburger Forscher konnten jetzt zeigen, wie dieser Vorgang reguliert wird.
Tierische Zellen pflegen einen regen Briefverkehr: Sie verschicken mit Signalmolekülen gefüllte Membran-Bläschen, um miteinander zu kommunizieren. Wie dieser Vorgang reguliert wird, haben Wissenschaftler vom Rudolf-Virchow-Zentrum für experimentelle Biomedizin entschlüsselt; die Ergebnisse ihrer Arbeit stellen sie in der aktuellen Ausgabe der Fachzeitschrift PNAS vor. Auf langer Sicht könnte auch die Medizin von diesen Erkenntnissen profitieren.
Interaktion zwischen Zellen
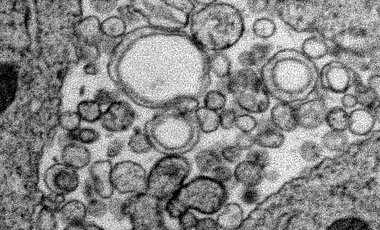
Jede tierische Zelle ist von einem hauchdünnen Häutchen umgeben, das sie von ihrer Umgebung abgrenzt. Dieses Häutchen besteht aus einer Doppelschicht fettähnlicher Moleküle, so genannter Lipide. Die Zellen können diese Doppelmembran auch nutzen, um darin Informationen zu verpacken und diese zu verschicken - ganz ähnlich wie in einem Briefumschlag. Sie schnüren dazu ein kleines Bläschen nach außen ab, ein Vesikel, das sie zum Beispiel mit einem bestimmten Signalmolekül füllen. Auf diese Weise können etwa benachbarte Zellen ihr Verhalten koordinieren.
Um die Existenz dieser interzellulären Briefpost wussten Forscher schon lange. Wie sie genau reguliert wird, war aber noch weitgehend unbekannt. Wissenschaftler um Dr. Ann Wehman sind bei der Klärung dieser Frage nun ein Stück weiter gekommen. „Wir konnten feststellen, dass bei der Bildung der Vesikel ein bestimmtes Enzym eine zentrale Rolle spielt, die TAT-5-Flippase“, erklärt Katharina Beer, die in der Arbeitsgruppe von Dr. Wehman promoviert.
TAT-5 verhindert das „Ausflippen“
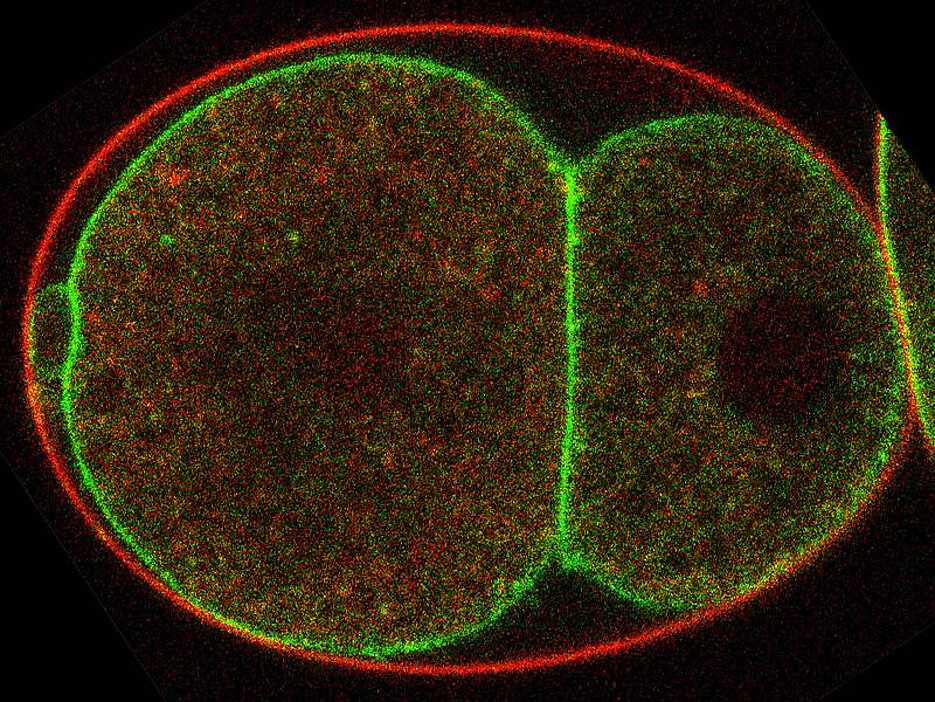
Die Doppelmembran besteht aus einer inneren und einer äußeren Lipidschicht. In beide Schichten sind zusätzlich zahlreiche unterschiedliche Moleküle eingebettet. Manche von ihnen sind für eine bestimmte Seite spezifisch. Ein Beispiel für diese Asymmetrie ist die Verteilung der so genannten PE-Lipide. Sie halten sich normalerweise immer in der Innenmembran auf. Die TAT-5-Flippase sorgt dafür, dass dieses Verteilungsmuster erhalten bleibt: Sobald PE-Moleküle in die äußere Membran wechseln, „flippt“ das Enzym die Irrläufer wieder auf die Innenseite zurück.
Doch was passiert, wenn die TAT-5-Flippase ausfällt? In diesem Fall sammeln sich in der Außenmembran viele PE-Lipide an. Gleichzeitig beginnt die Zelle damit, zahlreiche Vesikel abzuschnüren. „Augenscheinlich wird dieser Prozess durch die Umverteilung der PE-Moleküle initiiert“, erläutert Katharina Beer.
Die Wissenschaftler haben in Fadenwürmern verschiedene Gene analysiert, die an der Bildung der Vesikel beteiligt sind. Dabei sind sie auf insgesamt acht Erbanlagen gestoßen, die für die korrekte Funktion der TAT-5-Flippase sorgen. Eine von ihnen reguliert direkt die Aktivität des „Asymmetrie-Enzyms“. Die anderen sorgen dafür, dass die Flippase zur Zellmembran gelangt und dort ihre Aufgabe wahrnehmen kann. „Wir haben diese Gene in den Würmern ausgeschaltet - entweder einzeln oder zwei auf einmal“, sagt Beer. „In der Folge kam es dann zu einer massiven Produktion von Vesikeln.“
Zuviel des Guten
Durch die große Zahl der Membran-Bläschen wurde die Embryonalentwicklung der Würmer massiv gestört. „Es ist“, sagt Wehman, „als würden die Zellen auf Murmeln laufen und dadurch nicht voran kommen.“ Bei manchen Embryos entwickelte sich daher beispielsweise der Darm nicht innerhalb des Körpers, sondern an seiner Oberfläche.
Warum die Verteilung der PE-Lipide einen solch gravierenden Einfluss auf die Vesikel-Produktion hat, wird die Arbeitsgruppe jetzt detaillierter erkunden. Wehman konnte für dieses bevorstehende Projekt circa eine halbe Million Euro Forschungsgeld von der Deutschen Forschungsgemeinschaft (DFG) einwerben.
Diese Prozesse genauer aufzuklären, ist auch aus medizinischer Sicht wichtig. So weiß man, dass Krebszellen in großen Mengen Membran-Bläschen abschnüren, deren Botenstoffe das Tumorwachstum fördern. Immunzellen nutzen den interzellulären Briefdienst dagegen, um einander über eine Infektion zu informieren. Auch an der Entstehung von Blutgerinnseln, etwa bei einem Herzinfarkt oder Schlaganfall, spielt die Kommunikation über extrazelluläre Vesikel eine wesentliche Rolle.
Mittelfristig werden die Ergebnisse der Würzburger Forscher dazu beitragen, diese Vorgänge besser zu verstehen. Auf lange Sicht könnten sie dabei helfen, die Behandlung bestimmter Erkrankungen zu verbessern.
Katharina B. Beer, Jennifer Rivas-Castillo, Kenneth Kuhn, Gholamreza Fazeli, Birgit Karmann, Jeremy F. Nance, Christian Stigloher und Ann M. Wehman: Extracellular vesicle budding is inhibited by redundant regulators of TAT-5 flippase localization and phospholipid asymmetry; PNAS, Januar 2018; DOI: 10.1073/pnas.1714085115
Die Beteiligten
Dr. Ann Wehman leitet seit 2013 eine Arbeitsgruppe am Rudolf-Virchow-Zentrum für experimentelle Biomedizin der Universität Würzburg.
Katharina Beer promoviert in der Arbeitsgruppe von Dr. Ann Wehman.
Kontakt
Katharina Beer (AG Wehman, Rudolf-Virchow-Zentrum Würzburg) T: (0931) 31-88955 , katharina.beer1@uni-wuerzburg.de
Dr. Daniela Diefenbacher (Pressestelle, Rudolf-Virchow-Zentrum) T: (0931) 31-88631, daniela.diefenbacher@uni-wuerzburg.de
Pressemitteilung des Rudolf-Virchow-Zentrums