Bakterien unter Stress
10.11.2020Um Stress-Situationen zu entschärfen, setzen Bakterien auf spezielle Ionenkanäle. Wie zwei dieser Kanäle aufgebaut sind und sich öffnen, hat nun ein internationales Forschungsteam entschlüsselt.
Wenn es zu regnen anfängt, kann das für Bodenbakterien gefährlich werden: Der Regen lässt die Salzkonzentration in ihrer Umgebung sinken, und dadurch strömt vermehrt Wasser in die relativ salzreichen Bakterienzellen hinein. Das kann sie zum Platzen bringen.
Um diese Gefahr abzuwehren, besitzt das Bakterium Escherichia coli ganze sieben unterschiedliche Sorten von Ionenkanälen in seiner Zellmembran. Diese Kanäle reagieren auf mechanischen Druck und funktionieren wie Türen. Sie können Ionen in die Zelle hinein- oder aus ihr herausschleusen. Damit die Bakterien bei Regenwetter nicht platzen, schaffen sie Ionen nach draußen. Das Zellinnere wird dadurch salzärmer, der Innendruck sinkt.
Derartige Kanäle, die auf mechanische Reize reagieren, gibt es bei Bakterien in großer Zahl und unterschiedlichen Ausprägungen. Oft kommen in einem einzigen Bakterium mehrere Versionen dieser sogenannten mechanosensitiven Kanäle vor. "Den Grund für diese extreme Vielfalt kennt die Wissenschaft bislang nicht", sagt Professorin Bettina Böttcher von der Julius-Maximilians-Universität (JMU) Würzburg.
Entschlüsselt mit Elektronen-Kryomikroskopie
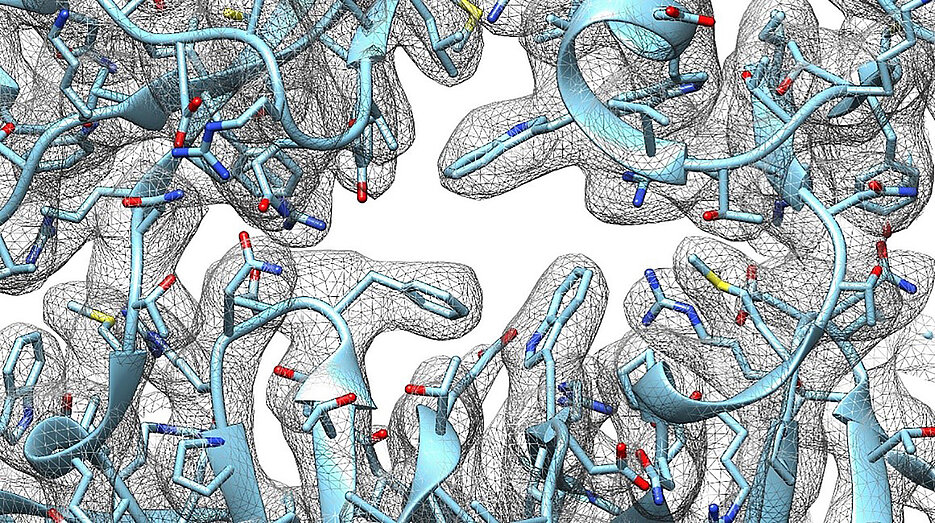
Bis dato war nur der einfachste Ionenkanal aus dieser Familie einigermaßen gut erforscht. Ein Team um Bettina Böttcher präsentiert nun im Journal PNAS die molekularen Strukturen zweier weiterer Kanäle (Ynal und YbiO) aus der sogenannten MscS-Familie. Entschlüsselt wurden die Strukturen mit Hilfe der Elektronen-Kryomikroskopie.
Böttchers Gruppe, die am Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging der JMU forscht, kooperierte für diese Studie mit den Gruppen von Professor Rainer Hedrich (Molekulare Pflanzenphysiologie und Biophysik, JMU), Professor Mark Sansom von der University of Oxford und Professor Renato Zenobi von der ETH Zürich.
Durch die Kenntnis der hochaufgelösten Kanal-Strukturen können die Wissenschaftlerinnen und Wissenschaftler jetzt unter anderem besser verstehen, wie der Öffnungsmechanismus, also die „Türklinke“, funktioniert.
Mechanosensitive Kanäle auch beim Menschen
„Nur wenn wir bakterielle Abwehrmechanismen im Detail verstehen, können wir auch erfolgreich krankheitserregende Bakterien bekämpfen“, betont Böttcher.
„Außerdem sind mechanosensitive Kanäle auch beim Menschen an wichtigen biologischen Funktionen beteiligt, wie zum Beispiel an der Blutdruckregulation und dem Hören. Ihre grundlegende Mechanismen sind aber bisher nur unzureichend erforscht. Deswegen ist Grundlagenforschung hier so wichtig“, ergänzt Dr. Tim Rasmussen, Postdoktorand in der Arbeitsgruppe Böttcher.
Publikation
Vanessa Judith Flegler, Akiko Rasmussen, Shanlin Rao, Na Wu, Renato Zenobi, Mark S.P. Sansom, Rainer Hedrich, Tim Rasmussen and Bettina Böttcher; The mechanosensitive MscS-like channel Ynal has a gating mechanism based on flexible pore helices. PNAS, November 2020, DOI: 10.1073/pnas.2005641117
Kontakt
Prof. Dr. Bettina Böttcher, Rudolf-Virchow-Zentrum, Universität Würzburg, T +49 (0)931 31-84193, bettina.boettcher@uni-wuerzburg.de
Dr. Tim Rasmussen, Rudolf-Virchow-Zentrum, Universität Würzburg, T +49 (0)931 31-89659, tim.rasmussen@uni-wuerzburg.de