Identifizierung eines Ferroptose-Suppressor-Proteins ermöglicht einen neuen Ansatz zur Behandlung von Krebs
21.10.2019Ein Forscherteam unter der Leitung des Helmholtz Zentrums München und der Universität Würzburg identifizierte ein Enzym, welches vor dem eisenabhängigen Zelltod Ferroptose schützt: Ferroptose-Suppressor-Protein-1, kurz FSP1. Dieses Protein wird in einer Vielzahl von Krebszelllinien exprimiert und stellt daher ein attraktives medikamentöses Ziel für neuartige, auf Ferroptose-basierenden Krebsbehandlungen dar. Die Erkenntnisse wurden in der Fachzeitschrift Nature veröffentlicht.
Tatsächlich macht der erste FSP1-Inhibitor, wie in der Studie der Forscher in Nature beschrieben, Tumorzellen für Ferroptose empfindlich und liefert somit die Grundlage für die Entwicklung von hochwirksamen Kombinationstherapien.
Beim Einsatz von herkömmlichen Chemotherapien entkommen oft wenige Krebszellen der Behandlung. Diese bilden Resistenzen aus, was zu Rückfällen führt und die klinische Behandlung einer Vielzahl von Tumorentitäten an ihre Grenzen bringt. Metabolische Veränderungen, der Übergang von Epithelzellen in Zellen mit mesenchymalen Eigenschaften sowie die Immunabwehr sind einige der dafür zugrundeliegenden Prozesse. Diese wurden kürzlich mit einer erworbenen Empfindlichkeit für Ferroptose in Verbindung gebracht. Die sogenannten „persistierenden“ Krebszellen entwickeln dabei eine starke Abhängigkeit von Glutathion Peroxidase 4 (GPX4), dem bereits bekannten Regulator von Ferroptose. GPX4 wurde bisher in Säugetierzellen als das einzige Enzymsystem betrachtet, das Peroxide in der Phospholipid-Doppelmembran unter Verwendung des Tripeptids Glutathion, dem in Säugetierzellen am häufigsten vorkommenden natürlichen Antioxidans, wirksam reduzieren und dadurch entgiften kann.
FSP1 – ein stark anti-ferroptotisch wirkendes Gen
Um neue Wege zur Anwendung von Ferroptose in der Krebstherapie zu erkunden, versuchte das Forscherteam zunächst das Rätsel zu lösen, warum bestimmte Krebszellen ferroptoseresistent sind, trotz der Expression von ACSL4 – einem bereits bekannten prädiktiven Marker für die Ferroptose-Empfindlichkeit (Doll et al., Nat. Chem. Biol. 2017). Das Forscherteam um Dr. Sebastian Doll und Dr. Marcus Conrad vom Institut für Entwicklungsgenetik des Helmholtz Zentrums München sowie Dr. Florencio Porto Freitas und Dr. José Pedro Friedmann Angeli der Universität Würzburg (Rudolf-Virchow-Institut) verwendeten hierzu eine cDNA-Bibliothek aus einer ferroptoseresistenten Brustkrebszelllinie. Ziel war es, neue genetische Ferroptose-Suppressoren ausfindig zu machen. Dabei gelang ihnen die Identifizierung und Beschreibung von FSP1, das zuvor fälschlicherweise als AIFM2 (Apoptosis Inducing Factor Mitochondria Associated 2) bezeichnet wurde, als anti-ferroptotisches Gen.
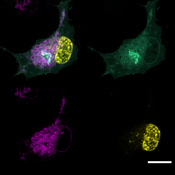
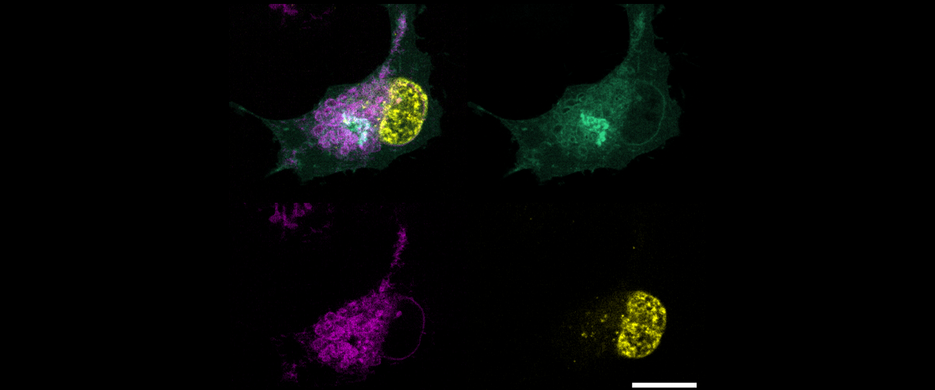
FSP1 kann den Verlust von GPX4, dem bislang einzig bekannten Enzym, welches Lipidperoxidation und damit verbundene Ferroptose verhindern kann, vollständig ausgleichen. Bei der Bestimmung der biochemischen Funktion von FSP1 stellten die Forschenden fest, dass das Hemmen der Lipidperoxidation von der Anwesenheit von Ubichinon-10 (auch als Coenzym Q10 bekannt) abhängig ist.
„Der Mechanismus, durch welchen FSP1 Zellen vor Ferroptose schützt, ist einzigartig und neu. FSP1 hält Ubichinon-10 in seinem reduzierten Zustand und verhindert dadurch radikalische Kettenreaktionen, die die Zellmembran schädigen würden. Letztendlich haben wir festgestellt, dass dies der Mechanismus ist, der Ferroptose verhindert“, erklärt Dr. Friedmann Angeli.
„In einem nächsten Schritt haben wir rund 10.000 arzneimittelähnliche Verbindungen in einem phänotypischen, zellbasierten, Screen- und Target-orientierten Validierungtest untersucht und somit den ersten FSP1-Inhibitor (iFSP1) identifiziert“, beschreibt Dr. Bettina Proneth des Teams am Helmholtz Zentrum München das Vorgehen.
Dr. Sebastian Doll, Erstauthor der Studie, führt fort: „Da wir festgestellt haben, dass FSP1 in den meisten Krebszelllinien exprimiert wird, stellen neuartige FSP1-Inhibitoren interessante Kandidaten für die Entwicklung von Krebsmedikamenten dar“.
Wichtiger Impuls für künftige Krebstherapien auf Ferroptosebasis
Mit dieser Studie beschreibt das Forscherteam einen bislang unbekannten Mechanismus, wie Zellen vor dem durch Lipidperoxidation verursachten ferroptotischen Zelltod geschützt werden können. Es konnte zeigen, dass dieses System eine starke Resistenz gegen bekannte Ferroptose-induzierende Medikamente bieten kann. Damit liefern die Forschenden zusätzlich eine Erklärung für das lange bestehende Rätsel, warum Zellen große Mengen an extra-mitochondrialem Ubichinon-10 enthalten.
„Diese Studie hat weitreichende Auswirkungen: Sie fordert die Entwicklung neuartiger und zielbasierter Ferroptose-Induktoren. Sie legt die Entwicklung von FSP1 als Biomarker für zukünftige ferroptosebasierte Therapien nahe. Nicht zuletzt verlangt sie die Neubewertung von Ubichinon-10 als leistungsfähigen anti-ferroptotischen Wirkstoff“, folgert Dr. Marcus Conrad.
Die Krebstherapie ist in der Anfangsphase der Behandlung oft hochwirksam, aber in vielen Fällen springt der Tumor des Patienten nicht mehr darauf an. Da bestimmte therapieresistente Tumore, speziell auch solche, die eine Entdifferenzierung durchlaufen sind, einen Ferroptose-sensitiven Zustand entwickeln, müssen pro-ferroptotische Behandlungsparadigmen, die auf dem Hemmen von FSP1, GPX4 oder einer Kombination davon beruhen, künftig in der Klinik Anwendung finden.
München im Zentrum internationaler Forschung
Diese Forschungsarbeit wurde vom Development Grant des Helmholtz Zentrums München für FSP1- Inhibitoren (2018) und der Deutschen Forschungsgemeinschaft gefördert. Die Studie wurde vom Helmholtz Zentrum München initiiert und in enger Zusammenarbeit mit dem Rudolf-Virchow-Zentrum der Universität Würzburg umgesetzt. Wichtige Beiträge steuerten außerdem die Cardiff University, die University of Ottawa, das Imperial College London und die University of California, Berkeley bei.
Publikation
Sebastian Doll, Florencio Porto Freitas, Ron Shah, Maceler Aldrovandi, Milene Costa da Silva, Irina Ingold, Andrea Goya Grocin, Thamara Nishida Xavier da Silva, Elena Panzilius, Christina Scheel, André Mourão, Katalin Buday, Mami Sato, Jonas Wanninger, Thibaut Vignane, Vaishnavi Mohana, Markus Rehberg, Andrew Flatley, Aloys Schepers, Andreas Kurz, Daniel White, Markus Sauer, Michael Sattler, Edward William Tate, Werner Schmitz, Almut Schulze, Valerie O’Donnel, Bettina Proneth, Grzegorz M. Popowicz, Derek Pratt, José Pedro Friedmann Angeli, Marcus Conrad: FSP1 is a glutathione-independent ferroptosis suppressor. Oct 2019, Nature, DOI: 10.1038/s41586-019-1707-0.0
Personen
- Dr. Florencio Porto Freitas (Postdoktorand) forscht in der Arbeitsgruppe von Dr. José Pedro Friedmann Angeli am Rudolf-Virchow-Zentrum für Experimentelle Biomedizin der Universität Würzburg.
- Dr. José Pedro Friedmann Angeli leitet seit 2018 eine Forschungsgruppe am Rudolf-Virchow-Zentrum für Experimentelle Biomedizin der Universität Würzburg.
- Prof. Dr. Markus Sauer leitet seit 2009 den Lehrstuhl für Biotechnologie und Biophysik im Biozentrum der Universität Würzburg. Website
- Prof. Almut Schulze leitete bis Sep 2019 eine Forschungsgruppe an dem Lehrstuhl für Biochemie und Molekularbiologie der Universität Würzburg. Website
Das Rudolf-Virchow-Zentrum
Das Rudolf-Virchow-Zentrum gehört als Zentrale Einrichtung zur Universität Würzburg. Die Forschungsgruppen arbeiten auf dem Gebiet der Schlüsselproteine, die für die Funktion von Zellen und damit für Gesundheit und Krankheit besonders wichtig sind.
Kontakt
Dr. José Pedro Friedmann Angeli (Rudolf-Virchow-Zentrum)
Tel. 0931 31-85547, pedro.angeli@virchow.uni-wuerzburg.de
Dr. Daniela Diefenbacher (Pressestelle, Rudolf-Virchow-Zentrum)
Tel. 0931 3188631, daniela.diefenbacher@uni-wuerzburg.de