Seifenmoleküle öffnen Proteinkanäle aus der Bakterienmembran
24.08.2021Bestimmte Kanalproteine in Bakterien werden durch Seifenmoleküle reversibel geöffnet. Die Kanäle gehören zu den Abwehrmechanismen von Bakterien und sind deshalb auch für den medizinischen Bereich interessant. Eine Würzburger Forschungsgruppe veröffentlichte diese Ergebnisse in der renommierten Fachzeitschrift PNAS.
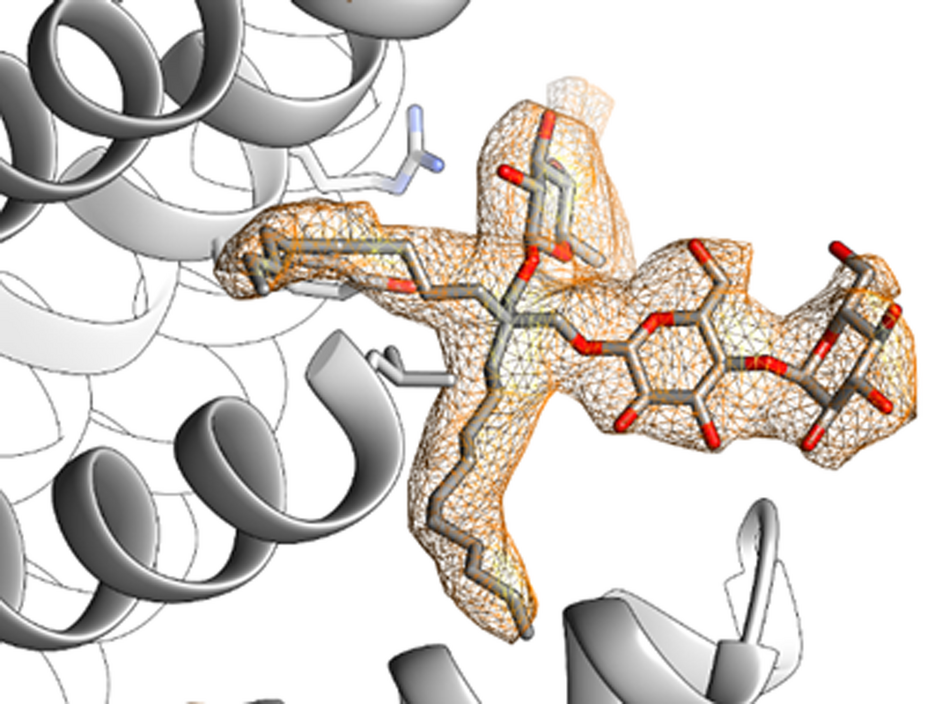
Bakterien nutzen spezielle Kanalproteine durch die sie Flüssigkeit und Ionen aus der Zelle schleusen können, um sich im Notfall vor dem Platzen zu schützen. Die Forschungsgruppe um Prof. Dr. Bettina Böttcher vom Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging der Universität Würzburg entdeckte nun, dass bestimmte Fettmoleküle (Lipide), welche die bakterielle Membran aufbauen, den Öffnungsmechanismus steuern. Da auch schädliche Bakterien diesen Schutzmechanismus anwenden, ist es relevant die zugrundeliegenden Mechanismen zu kennen.
Abgewaschene Lipide führen zur Öffnung
Bekannt war bisher, dass die mechanische Spannung der Membran, in der die Kanalproteine eingebettet sind, über „Fühler“ von den Proteinen gemessen wird und bei großer Spannung zur Öffnung der Kanäle führt. Böttcher und ihre Gruppe zeigten jetzt, dass auch Lipide die sich an Falten und Taschen des Proteins anlagern, eine wichtige Rolle bei der Steuerung spielen. Dazu behandelten die Wissenschaftler und Wissenschaftlerinnen die Proben, in denen die Proteine ohne umgebende Membran vorlagen, mit unterschiedlichen Seifenlösungen. „Die Seifenmoleküle waschen die angelagerten Lipide langsam ab, es kommt zu Strukturveränderungen und die Kanäle öffnen sich. Werden wieder mehr Lipide dazu gegeben, dann kehrt sich der Vorgang um und die Kanäle schließen sich wieder“, erklärt Böttcher.
Studentinnen werden Mitautorinnen der Studie
Eine Besonderheit dieser Studie ist die enge Verknüpfung von Forschung und Lehre. Die Studentinnen des Praktikums „Elektronenmikroskopie und Bildverarbeitung“ des letzten Jahres nahmen die Messungen an den forschungsrelevanten Proben vor und trugen so maßgeblich zu der Veröffentlichung bei. „Die Verknüpfung von Lehre und Forschung ist nicht immer leicht, da die forschungsrelevanten Proben aufwendiger in der Vorbereitung und risikoreicher in der Untersuchung sind als typische Proben, die für Praktika verwendet werden“ stellt Böttcher klar. Julia Halang, eine der Studentinnen erzählt begeistert: "Das Praktikum hat mir einen Einblick in die Elektronenmikroskopie geboten, den ich anders nie erhalten hätte. Dabei durften wir bei der Probenvorbereitung bis hin zur Bildaufnahme und der Prozessierung alles durchführen. Dafür bin ich sehr dankbar!“
Publikation
Vanessa Judith Flegler, Akiko Rasmussen, Karina Borbil, Lea Boten, Hsuan-Ai Chen, Hanna Deinlein, Julia Halang, Kristin Hellmanzik, Jessica Löffler, Vanessa Schmidt, Cihan Makbul, Christian Kraft, Rainer Hedrich, Tim Rasmussen and Bettina Böttcher; Mechanosensitive channel gating by delipidation. PNAS (2021) doi: 10.1073/pnas.2107095118.
Personen
Prof. Dr. Bettina Böttcher ist Professorin für Biochemie und leitet seit 2016 eine Forschungsgruppe am Lehrstuhl für Biochemie und am Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging der Universität Würzburg.
Dr. Tim Rasmussen forscht als Postdoktorand in der Arbeitsgruppe von Bettina Böttcher am Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging der Universität Würzburg.
Kontakt
Prof. Dr. Bettina Böttcher (Rudolf-Virchow-Zentrum, Universität Würzburg)
Tel.: +49 (0)931 31 84193, bettina.boettcher@uni-wuerzburg.de
Dr. Tim Rasmussen (AG Böttcher, Rudolf-Virchow-Zentrum)
Tel.: +49 (0)931 31 89659, tim.rasmussen@uni-wuerzburg.de
Dr. Judith Flurer (Pressestelle, Rudolf-Virchow-Zentrum)
Tel.: +49 (0)931 31 85822, judith.flurer@virchow.uni-wuerzburg.de