Spahn Gruppe

Willkommen auf der Seite der Forschungsgruppe "Nanoscale Bacteriology"!
Im Nanoscale Bacteriology Lab untersuchen wir die molekulare Organisation von Bakterien. Hierzu verwenden wir verschiedene Mikroskopie-Methoden, allen voran Höchstauflösende Mikroskopie. Diese Gruppe von Mikroskopiemethoden ermöglicht es, Bilder von biologischen Proben und Strukturen mit einer Auflösung von wenigen Nanometern zu erzeugen. Im Vergleich zu konventioneller Lichtmikroskopie (z.B. Weitfeld- oder konfokale Fluoreszenzmikroskopie) stellt dies eine Auflösungsverbesserung um den Faktor 10 - 30 dar. Dies ermöglicht uns, Proteine, Nukleinsäuren und andere Biomoleküle auf nahezu molekularer Ebene und im Kontext intakter, einzelner Zellen zu untersuchen.
Da die Möglichkeiten für die mehrfarbige Höchstauflösende Fluoreszenzmikroskopie in Bakterien begrenzt sind, etablieren und entwickeln wir Methoden, die die gleichzeitige Visualisierung verschiedener Ziele ermöglichen. Dazu gehören Einzelmolekül-basierte Techniken (Single-molecule localization microscopy, SMLM), STED-Mikroskopie und Lebendzell-Mikroskopie. In Verbindung mit künstlicher Intelligenz liefern diese Markierungs- und Bildgebungsverfahren umfangreiche Informationen zu diversen biologischen Fragestellungen. Wir sind auch an der Entwicklung intelligenter Mikroskopieverfahren interessiert, welche z.B. Hochdurchsatzmikroskopie im Bereich der Wirkstoffentdeckung verfeinert und beschleunigt.
Biologisch liegt ein Hauptaugenmerk der Gruppe auf der Untersuchung der Transertion. Transertion beschreibt eine Kopplung von Transkription, Translation und Insertion von Membranproteinen, ein postulierter aber noch unzureichend aufgeklärter Mechanismus, der die bakterielle chromosomale DNA (das sogenannte Nukleoid) dynamisch mit der Bakterienmembran verbindet. Da Bakterienzellen winzig sind, erfordert die Untersuchung dieses Prozesses eine räumliche Auflösung im Nanometerbereich. Durch systematische Störungen der zellulären Prozesse mit Antibiotika konnte gezeigt werden, dass die Proteinbiosynthese stark zur Organisation des bakteriellen Nukleoids beiträgt. In unserer zukünftigen Arbeit wollen wir die molekularen Mechanismen hinter dieser Organisation entschlüsseln, sowohl in unserem Modellorganismus Escherichia coli, als auch in gram-negativen Krankheitserregern.
Insgesamt ermöglicht unser breites Methodenspektrum zukünftig die Untersuchung diverser weiterer biologischer Fragestellungen. Hierzu gehören unter Anderem:
- Aufbau bakterieller Biofilme
- Mikrobielle Resistenzmechanismen
- Pathogen-Wirtszell-Interaktionen
Höchstauflösende Fluoreszenzmikroskopie
Einzelmolekül-Lokalisationsmikroskopie (SMLM)
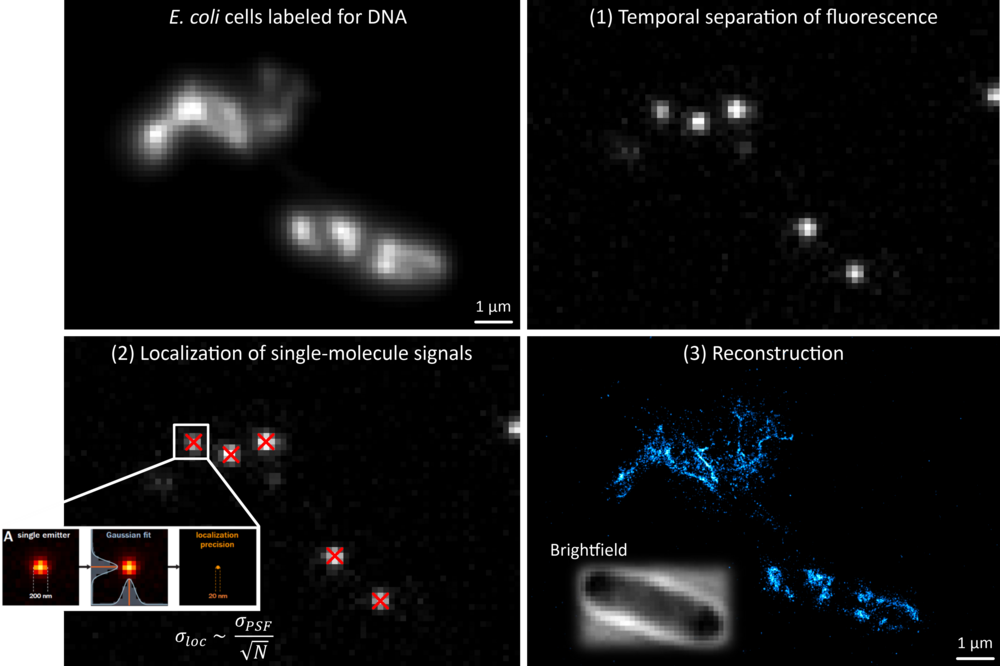
Ein Schwerpunkt unserer Forschung ist die Entwicklung von höchstauflösenden Mikroskopiemethoden, insbesondere für den Einsatz in der Mikrobiologie. Wir verwenden hauptsächlich die Einzelmolekül-Lokalisationsmikroskopie (SMLM) (Abb. 1), bei welcher das Fluoreszenzsignal zeitlich aufgetrennt wird und einzelne Farbstoffmoleküle (Emitter) mit hoher Präzision lokalisiert werden können. Aus den Koordinaten vieler Moleküle wird ein künstliches Bild mit >10-fach verbesserter Auflösung und erhöhtem Kontrast rekonstruiert.
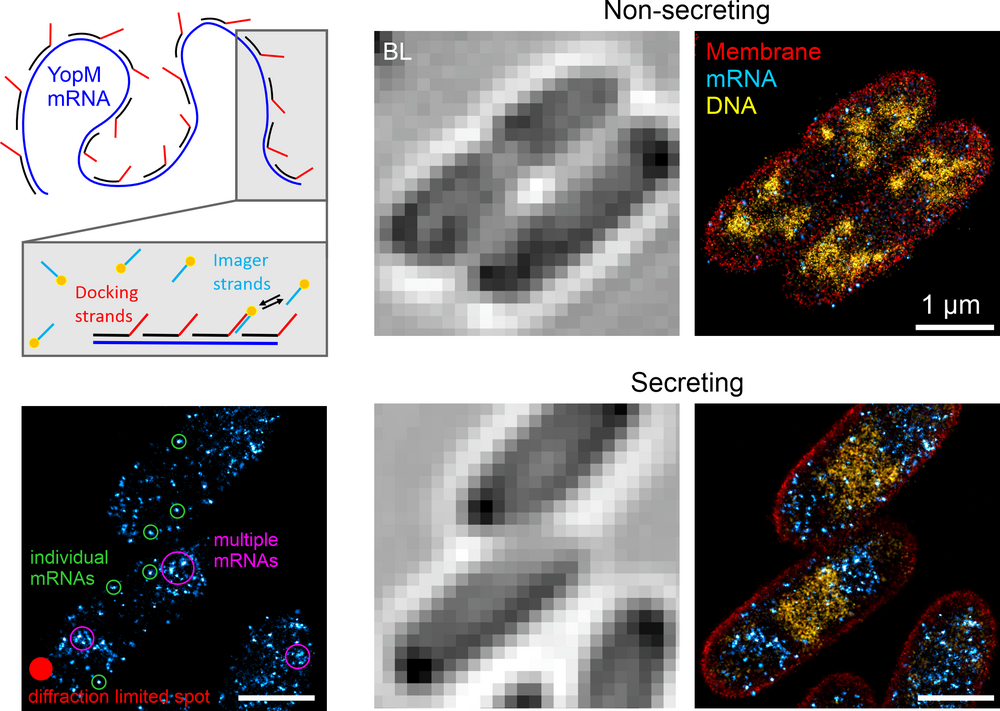
Insbesondere haben wir Werkzeuge entwickelt, um die Organisation chromosomaler DNA (das ‚Nukleoid‘) in fixierten Bakterienzellen zu untersuchen. Ausgehend von einem EdU-basierten metabolischen Markierungsansatz in Kombination mit direct Stochastic Optical Reconstruction Microscopy (dSTORM) [1] sind wir zu reversibel bindenden Sonden übergegangen, die für Point Accumulation for Imaging in Nanoscale Topography (PAINT) verwendet werden können [2]. Zusammen mit dem Labor von Luke Lavis (Janelia Farm, USA) haben wir eine Palette von DNA- und membranbindenden PAINT-Sonden getestet, die eine multiplexe Bildgebung des Nukleoids und der Membranen in verschiedenen Farbkombinationen ermöglichen. Dieser einfache Ansatz ist sehr vielseitig und ermöglicht höchstauflösende Bildgebung unabhängig von aktiver Replikation. Wir konnte damit zeigen, dass das Nukleoid von E. coli während schnellen Wachstums stark strukturiert ist und dass es sich in unmittelbarer Nähe der inneren Membran befindet [3].
Kürzlich haben wir diesen Ansatz genutzt, um die Reaktion des E. coli-Nukleoids auf Störungen zu untersuchen. Höchstauflösende Messungen von Antibiotika-behandelten Zellen zeigten eine schnelle Reorganisation des Nukleoids, insbesondere während der Hemmung der Transkription und Translation. Wir glauben, dass dies auf die Transertion zurückzuführen ist, die dynamische Kopplung von Transkription, Translation und Membraninsertion/Translokation von Proteinen [4].
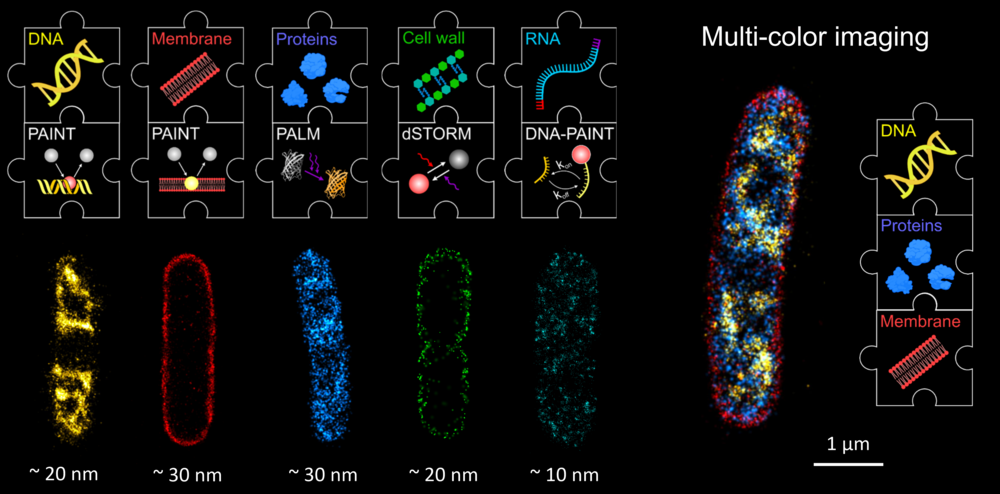
SMLM erlaubt die Visualisierung verschiedener biologischer Strukturen (Abb. 2). Die Kombination dieser Techniken in Mehrfarben-Mikroskopie gibt scharfe Einblicke in die Organisation einzelner Bakterienzellen.
STED Mikroskopie
Hochwertige Einzelmolekül-Bildgebung erfordert eine robuste räumliche und zeitliche Trennung des Fluoeszenzsignals. Dies ist jedoch bei heterogenen Strukturen, die sowohl Bereiche mit starker als auch schwacher Dichte aufweisen, eine Herausforderung. Als Alternative zu SMLM haben wir die Verwendung von transient bindenden Sonden in hoher Konzentration untersucht. Eine ausreichend hohe Konzentration von PAINT-Sonden (typischerweise 100 – 500 nM) sorgt für eine pseudo-permanente Markierung, die effizient für die STED-Bildgebung genutzt werden kann [5]. Der ständige Austausch der Markierungen umgeht Probleme durch Photobleichen, welches oft ein limitierender Faktor für eine hochwertige STED-Mikroskopie ist.
Die optische Sektionierung in der STED-Mikroskopie umgeht das Problem des hohen Hintergrunds durch die Verwendung nicht-fluorogener Sonden. Wir haben das Konzept der STED mit austauschbaren Markern erfolgreich auf Sonden wie Lifeact und fluoreszenzmarkierte DNA-Oligos angewendet, wie sie in DNA-PAINT verwendet werden [5, 6]. Wir glauben, dass dieses Konzept auf alle Marker verallgemeinert werden kann, die bestimmte kinetische Eigenschaften erfüllen (hohe nM- bis niedrige µM-Affinität, hohe On- und Off-Raten).
![Abb. 3: xSTED Mikroskopie mit austauschbaren Sonden. [A] Schematische Darstellung. Zielstrukturen (hier: Plasmamembran) wird mittels einer hohen Konzentration transient bindender Sonden markiert. Farbstoffe, die während der STED Messung photobleichen, werden durch neue, ungebleichte Farbstoffe ausgetauscht. [B] Zweifarben-xSTED Messung von <i>E. coli</i> Zellen, angefärbt für DNA (gelb) und Membranen (rot). [C] xSTED Mikroskopie von Mitochondrien und ER-Netzwerken. [D] Zweifarben-xSTED Messungen von DNA-markierten Zielproteinen. image description](/fileadmin/_processed_/2/a/csm_xSTED_8741ac0110.png)
Chromosomenorganisation in Bakterien
Unser größtes biologisches Interesse gilt der Organisation des bakteriellen Chromosoms. Uns fasziniert die morphologische Vielfalt des Nukleoids und die molekularen Mechanismen, welche der Replikation, Segregation und 3-dimensionaler Anordnung bakterieller Chromosomen zu Grunde liegen.
Die Morphologie des Nukleoids ist stark abhängig von externen und internen Faktoren, darunter das Nährstoffenangebot, Temperatur, Zelldichte oder das Vorhandensein bestimmter Wirkstoffe (z. B. Antibiotika, Toxine). Die geringe Größe des Nukleoids macht es zu einem idealen Ziel für höchstauflösende Mikroskopie, mit welcher wir dessen Verteilung und Morphologie mit einer Auflösung von ~30 nm abzubilden können. Dies erlaub es, subtile Unterschiede der Chromosomenorganisation unter verschiedensten Bedingungen aufdecken (Abb. 4).
Einige Antibiotika haben beispielsweise einen starken Einfluss auf die Zellform sowie die Verteilung der DNA innerhalb der Zelle (Abb. 4A) [3]. Dies macht man sich in bildbasierter Wirkstoffscreening zu Nutze, in welchem die unterschiedlichen Phänotypen als Indikator für die grobe Wirkungsweise (MoA) von Wirkstoffen dienen können. Wir denken, dass eine stark verbesserte Auflösung eine detaillierte Bewertung der Wirkungsweise von Antibiotika ermöglichen.
In Kollaboration mit Helge Bode (MPI für Terrestrische Mikrobiologie, Marburg) haben wir z.B. die Verteilung des antimikrobiellen Peptids PAX (Peptide Antimicrobial Xenorhabdus) untersucht (Abb. 4B) [7]. Höchstauflösende Aufnahmen zeigten so, dass das Peptid sowohl das Zytosol von E. coli Zellen flutet, als auch deren Membran solubilisiert.
Referenzen
[1] Spahn, C., Endesfelder, U. & Heilemann, M. “Super-resolution imaging of Escherichia coli nucleoids reveals highly structured and asymmetric segregation during fast growth.” Journal of Structural Biology 185 (3), 243-249 (2014). [link]
[2] Spahn, C., Glaesmann, M., Grimm, J.B., Ayala, A.X., Lavis, L.D., Heilemann, M., “A toolbox for multiplexed super-resolution imaging of the E. coli nucleoid and membrane using novel PAINT labels.” Scientific Reports 8, 14768 (2018). [link]
[3] Spahn, C., Middlemiss, S., Gómez-de-Mariscal, E., Henriques, R., Bode, H. B., Holden, S., Heilemann, M., “The nucleoid of rapidly growing Escherichia coli localizes close to the inner membrane and is organized by transcription, translation, and cell geometry.” Nat. Commun. 16, 3732 (2025) [link]
[4] Woldringh, C., “The role of co-transcriptional translation and protein translocation (transertion) in bacterial chromosome segregation.” Mol. Microbiol. 45, 17-29. [link]
[5] Spahn, C., Grimm, J.B., Lavis, L.D., Lampe, M., Heilemann, M., “Whole-Cell, 3D, and Multicolor STED Imaging with Exchangeable Fluorophores.” Nano Letters 19 (1), pp 500–505 (2018). [link]
[6] Spahn, C., Hurter, F., Glaesmann, M., Karathanasis, C., Lampe, M., Heilemann, M., “Protein-Specific, Multicolor and 3D STED Imaging in Cells with DNA-Labeled Antibodies.” Angewandte Chemie 58(52), pp 18835-18838 (2019). [link]
[7] Vo T.D., Spahn, C., Heilemann, M., Bode, H.B., “Microbial cationic peptides as a natural defense mechanism against insect antimicrobial peptides.” ACS Chemical Biology 16(3), pp 447-451 (2021) [link]
- Ermoli, F. #, Spahn, C.#, Sadhir, I., Bode, H.B., Diepold, A., "Activation of the Yersinia type III secretion system induces large-scale spatial reorganization of chromosomal and virulence plasmid DNA." Cell Reports, accepted (2025)
- Ermoli, F., Malengo, G., Spahn, C., Brianceau, C., Glatter, T., Diepold, A.,"Yersinia actively downregulates type III secretion and adhesion at higher cell densities." PLoS Pathog. 21(8):e1013423 (2025) [link]
- Spahn, C., Middlemiss, S., Gómez-de-Mariscal, E., Henriques, R., Bode, H. B., Holden, S., Heilemann, M., “The nucleoid of rapidly growing Escherichia coli localizes close to the inner membrane and is organized by transcription, translation, and cell geometry.” Nat. Commun. 16, 3732 (2025) [link]
- Pandi, A., Adam, D., Zare, A., Trinh, V.T., Schaefer, S.L., Wiegand, M., Klabunde B., Bobkova, E., Kushwaha, M., Foroughijabbari, Y., Braun, P., Spahn, C., Preußer, C., von Strandmann, E.P., Bode, H.B., von Buttlar, H., Bertrams, W., Jung, A.L., Abendroth, F., Schmeck, B., Hummer, G., Vázquez, O., Erb, T.J. “Cell-free biosynthesis combined with deep learning accelerates de novo-development of antimicrobial peptides.” Nat. Commun. 14, 7197 (2023) [link]
- Spahn, C., Gómez-de-Mariscal, E., Laine, F.L., Pereira, P. M., von Chamier, L., Condiut, M., Pinho, M.G., Jacquemet, G., Holden, S., Heilemann, M. & Henriques, R., “DeepBacs for multi-task bacterial image analysis using open-source deep learning approaches.” Commun. Biol. 5, 688 (2022) [link]
- Koller, N., Höllthaler, P., Barends, M., Döring, M, Spahn, C., Durán, V., Costa, B., Becker, J., Heilemann, M., Kalinke, U., Tampé, R., “Nanoscale organization of the MHC I peptide-loading complex in human dendritic cells.” Cell. Mol. Life Sci. 79(9):477 (2022) [link]
- Chamier, v.L.#, Laine#, R.F., Jukkala, J., Spahn, C., Krentzel, D., Nehme, E., Lerche, M., Hernández-Pérez, S., Mattila, P.K., Karinou, E., Holden, S., Solak, A.C., Krull, A., Buchholz, T.-O., Jones, M.L., Royer, L.A., Leterrier, C., Shechtman, Y., Jug, F., Heilemann, M., Jacquemet, G., Henriques, R., “Democratising deep learning for microscopy with ZeroCostDL4Mic.” Nature Communications 12, 2246 (2021) [link]
- Vo T.D.#, Spahn, C.#, Heilemann, M., Bode, H.B., “Microbial cationic peptides as a natural defense mechanism against insect antimicrobial peptides.” ACS Chemical Biology 16(3), pp 447-451 (2021) [link]
- Glogger, M., Spahn, C., Enderlein, J., Heilemann M., “Multi-Color, Bleaching-Resistant Super-Resolution Optical Fluctuation Imaging with Oligonucleotide-Based Exchangeable Fluorophores.” Angewandte Chemie (2020). [link]
- Spahn, C., Hurter, F., Glaesmann, M., Karathanasis, C., Lampe, M., Heilemann, M., “Protein-Specific, Multicolor and 3D STED Imaging in Cells with DNA-Labeled Antibodies.” Angewandte Chemie 58(52), pp 18835-18838 (2019). [link]
- Spahn, C., Grimm, J.B., Lavis, L.D., Lampe, M., Heilemann, M., “Whole-Cell, 3D, and Multicolor STED Imaging with Exchangeable Fluorophores.” Nano Letters 19 (1), pp 500–505 (2018). [link]
- Spahn, C.#, Glaesmann, M.#, Grimm, J.B., Ayala, A.X., Lavis, L.D., Heilemann, M., “A toolbox for multiplexed super-resolution imaging of the E. coli nucleoid and membrane using novel PAINT labels.” Scientific Reports 8, 14768 (2018). [link]
- Gao, Y.#, Spahn, C.#, Heilemann, M., Kenney, L.J., “The Pearling Transition Provides Evidence of Force-Driven Endosomal Tubulation during Salmonella Infection.” mBio 9, e01083-18 (2018). [link]
- Diekmann, R., Wolfson, D.L., Spahn, C., Heilemann, M., Schüttpelz, M. & Huser, T. “Nanoscopy of bacterial cells immobilized by holographic optical tweezers.” Nature Communications 7, 13711 (2016). [link]
- Spahn, C., Herrmannsdӧrfer, F., Kuner, T. & Heilemann, M. “Temporal accumulation analysis provides simplified artifact-free analysis of membrane-protein nanoclusters.” Nature Methods 13, 963–964 (2016). [link]
- Devraj, K., Poznanovic, S., Spahn, C., Schwall, G., Harter, P., Mittelbronn, M., Antoniello, K., Paganetti, P., Muhs, A., Heilemann, M., Hawkins, R.A., Schrattenholz, A. & Liebner, S. “BACE-1 is expressed in the blood-brain barrier endothelium and is upregulated in a murine model of Alzheimer’s disease.” Journal of Cerebral Blood Flow & Metabolism 36, 1281–1294 (2016). [link]
- Foo, Y. H.#, Spahn, C.#, Zhang, H., Heilemann, M. & Kenney, L. J. “Single cell super-resolution imaging of E. coli OmpR during environmental stress.” Integr. Biology 7, 1297–1308 (2015). [link]
- Spahn, C., Cella-Zannacchi, F., Endesfelder, U. & Heilemann, M. “Correlative super-resolution imaging of RNA polymerase distribution and dynamics, bacterial membrane and chromosomal structure in Escherichia coli.” Methods and Applications in Fluorescence 3, 014005 (2015). [link]
- Raulf, A., Spahn, C., Zessin, P. & Heilemann, M. “Click chemistry facilitates direct labelling and super-resolution imaging of nucleic acids and proteins.” RSC Advances 4, 30462–30466 (2014). [link]
- Spahn, C., Endesfelder, U. & Heilemann, M. “Super-resolution imaging of Escherichia coli nucleoids reveals highly structured and asymmetric segregation during fast growth.” Journal of Structural Biology 185 (3), 243-249 (2014). [link]
- Klehs, K., Spahn, C., Endesfelder, U., Lee, S.F., Fuerstenberg, A. & Heilemann, M. “Increasing the Brightness of Cyanine Fluorophores for Single-Molecule and Superresolution Imaging.” ChemPhysChem 15, 637–641 (2014). [link]
Dr. Christoph Spahn
Josef-Schneider-Straße 2

Kilian Andress
Josef-Schneider-Straße 2

Ruilan Xu
Josef-Schneider-Straße 2

Lars Köhler

PostDoc Position in Infection Biology and Advanced Imaging (f/m/d)
The Nanoscale Bacteriology Lab, led by Dr. Christoph Spahn, is looking for a PostDoc to study the intracellular organization of intracellular pathogens during infection.
Our research focusses on understanding the subcellular organization of bacteria and their response to antimicrobial compounds. We combine super-resolution microscopy (Spahn et al., 2018), drug treatments (Spahn et al., 2025) artificial intelligence (Spahn et al., 2022) and biochemical approaches to understand both fundamental concepts of bacterial cell biology and antibiotic action. Recently, we started to investigate how secretion alters the intracellular organization of pathogens (Ermoli et al., 2025).
In the advertised position, the successful candidate will investigate bacterial secretion during host-pathogen interaction. We will employ a combinatorial approach using live-cell imaging, multicolor super-resolution microscopy and genetics to gain fundamental knowledge about the dynamics of effector protein secretion and the effect on both host cells and pathogens.
The position is scheduled to last until the end of 2028.
Qualification profile
As a PostDoc applicant, you have completed a PhD in life sciences or related fields.
Essential qualifications
- Enthusiasm for science/basic research
- A strong background in the field of life sciences
- Experience in infection biology and/or molecular biology of bacterial pathogens
- Experience in bacterial and mammalian cell culture
- Experience in super-resolution microscopy or other advanced microscopy techniques, as well as image analysis
- Willingness to learn new techniques and explore novel ground
- Excellent team spirit and willingness to teach students
- Fluent English
Optional qualifications
- Experience in programming or with AI
- Experience in biochemistry
What we offer
At Julius-Maximilians-Universität Würzburg, more than 30,000 people from over 100 countries come together to study, research, teach and work. As a central institution of the University, the Rudolf Virchow Center is a modern research center with more than 100 international scientists investigating the molecular causes of health and disease. It has been established as a unique institution for translational bioimaging combining all existing imaging core structures and microscopy facilities.
The Rudolf Virchow Center is a highly competitive international research institute with an outstanding infrastructure. We have in-house access to state-of-the-art instrumentation and to an extensive range of modern biophysical and cell biological equipment. We are integrated into a stimulating cross-disciplinary environment that includes our partners at the Biocenter, the physics department, the Max Planck Research Group in Systems Immunology, the Institute for Molecular Infection Biology (IMIB), Helmholtz Institute for RNA-based Infection Research (HIRI) and the University Hospital in Würzburg.
Würzburg is located in the beautiful, wine-growing area of Franconia, in proximity of Frankfurt (1 hour by train) and Munich (2 hours). We have a lot of sun and many festivals in the summer, as well as impressive historical buildings and recreative nature.
The salary is commensurate with training and experience according to Collective Agreement for the Public Service of German Federal States TV-L (100%).
You will have access to both national and public-service pension schemes (VBL), health care, and are entitled to 30 days of holiday in addition to 13 annual public holidays in Bavaria. Our Welcome Center supports international candidates in finding accommodation as well as in administrative matters - and the University of Würzburg offers support for researchers with children, including flexible working hours and childcare.
Interested?
Applications including a cover letter, a detailed CV (2 pages max), a short summary of past research projects with publications (3 pages max), copies of certificates, and the contact information of two referees, should be sent via email as a single pdf file (not exceeding 10 MB). Applications will be screened continuously until the position is filled.
The University of Würzburg is an equal opportunity employer. As such, we explicitly encourage applications from qualified women.
Please send your application to:
Christoph.spahn@uni-wuerzburg.de with Cc to Inka.robinson@uni-wuerzburg.de
If you want to know more about the individual project and/or have further questions about the position, please contact me via the mail above.



![Abb. 4: Höchstauflösende Mikroskopie Wirkstoff-behandelter <i>E. coli</i> Zellen. [A] Phänotypen von Bakterienzellen, die mit unterschiedlichen Antibiotika behandelt wurden. [B] Lokalisation und Auswirkung des antimikrobiellen Peptids PAX.](/fileadmin/_processed_/6/7/csm_Drug_treatments_ABs_first_e3614aaac5.png)