P16 - Biophysics of immune-cell hijacking by Toxoplasma gondii
Physics of Parasitic Immune Hijacking
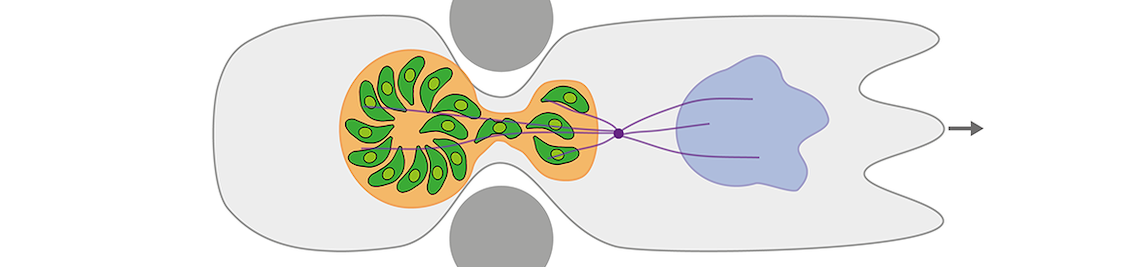
Upon entry into multicellular organisms, parasites like Toxoplasma gondii (T.gondii) disseminate within the host. Inside the host, they encounter tight tissue pores, large traveling distances, and maze-like extracellular fibrillar networks. To overcome these challenges, parasites can invade migratory host cells to be transported intracellularly. T.gondii (phylum Apicomplexa) is a well studied model parasite that hijacks migrating immune cells, taking advantage of their abilities to cross tissue barriers and rapidly migrate throughout the host. Moreover, T.gondii replicates inside intracellular parasitophorous vacuoles, thus turning immune cells into “Trojan horses”. Although some molecular biological data on parasitic immune-cell hijacking are increasingly available, key biophysical aspects of the trojan-horse mechanism are currently almost completely unresolved.
Our preliminary results show that infected immune cells are able to migrate through extraordinarily tight constrictions in spite of a large, bulky parasite ‘cargo’. The cargo is protected by a delicate, yet extremely resilient anatomy of the parasitophorous vacuole that contains a dynamic actin network and is surrounded by a cage-like host microtubule network. How locomotion of the host-parasite system is driven, how it is adapted to cargo, and how the active vacuole system gains its protective role and mechanical resilience is not known.
This knowledge gap will be filled by combining our expertise in experimental and theoretical methodology. To discover biophysical principles of immune-cell hijacking by T.gondii, we will employ advanced microscopy techniques (STED, STORM, TIRF), custom-designed microchannels and 3D matrices, parasite and immune cell mutants (cytoskeletal components), mechanical measurements (traction force microscopy, micropipette aspiration), and mathematical models for describing the viscoelastic response of the vacuole as well as for describing the locomotion of immune cells with parasite cargo. Our work will elucidate design principles and dynamics of the immune-cell parasite system, investigate possible synchronization of the mechanical activity of the host and the parasitophorous vacuole, and reveal the role of mechanical adaptation in optimal parasite cargo transport. Overall, these findings will shed light on the fundamental biophysical mechanisms underlying evolved parasitic strategies for generating Trojan horses, and explain how an optimized biological system for organism-wide transport of large foreign bodies can function.
Biophysikalische Mechanismen der Dissemination von Toxoplasma gondii mittels migratorischer Immunzellen
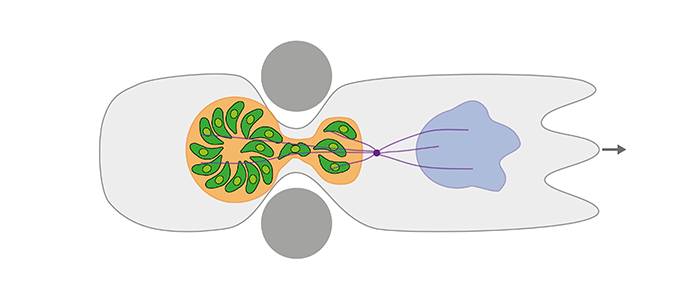
Nach dem Eindringen in mehrzellige Wirtsorganismen verbreiten sich Parasiten wie Toxoplasma gondii (T.gondii) durch das Gewebe. Im Inneren des Wirts treffen sie auf enge Gewebeporen, große zu durchwandernde Distanzen, und labyrinthartige extrazelluläre fibrilläre Netzwerke. Um diese Herausforderungen zu überwinden, können Parasiten in migrierende Wirtszellen eindringen, um intrazellulär transportiert zu werden. T.gondii (Phylum Apicomplexa) ist ein gut untersuchter Modellparasit, der wandernde Immunzellen kapert und sich deren Fähigkeiten zunutze macht, Gewebebarrieren zu überwinden und schnell im Wirt umher zu migrieren. Darüber hinaus repliziert T.gondii in intrazellulären parasitophoren Vakuolen und verwandelt so Immunzellen in "trojanische Pferde". Obwohl zunehmend molekularbiologische Daten zum parasitären Immunzell-Hijacking verfügbar sind, sind wesentliche biophysikalische Aspekte des Trojanisches-Pferd-Mechanismus gegenwärtig noch fast völlig ungeklärt. Unsere vorläufigen Ergebnisse zeigen, dass infizierte Immunzellen in der Lage sind, trotz einer großen, sperrigen Parasiten-"Fracht" durch außerordentlich enge Poren zu wandern. Die Parasiten werden dabei durch eine delikate, aber extrem widerstandsfähige Anatomie der parasitophoren Vakuole geschützt, die ein dynamisches Aktinnetzwerk enthält und von einem käfigartigen Mikrotubuli-Netzwerk umgeben ist. Wie die Fortbewegung des Wirt-Parasit-Systems angetrieben wird, wie sie an die Fracht angepasst ist und wie das aktive Vakuolensystem seine Schutzfunktion und mechanische Belastbarkeit erhält, ist nicht bekannt. Diese Wissenslücke soll durch die Kombination unserer Expertise in experimenteller und theoretischer Methodik geschlossen werden. Um die biophysikalischen Prinzipien des Immunzell-Hijacking durch T.gondii zu verstehen, werden wir anspruchsvolle Mikroskopietechniken (STED, STORM, TIRF), speziell angefertigte Mikrokanäle und 3D-Matrizen, Parasiten- und Immunzellmutanten (Zytoskelett-Komponenten), mechanische Messungen (Traction Force Mikroskopie, Mikropipettenaspiration) und mathematische Modelle für die viskoelastische Antwort der Vakuole und zur Beschreibung der Zellmigration einsetzen. Die Arbeit wird Konstruktionsprinzipien und die Dynamik des Immunzelle-Parasiten Systems aufklären, eine mögliche Synchronisation der mechanischen Aktivität von Wirt und parasitophorer Vakuole untersuchen, und die Rolle der mechanischen Adaption für den optimalen Transport der Parasitenfracht aufdecken. Im größeren Zusammenhang gesehen, werden die zu entschlüsselnden biophysikalischen Mechanismen zum Verständnis unterschiedlicher parasitärer Strategien beitragen und erklären, wie ein optimiertes biologisches System zum organismusweiten Transport großer Fremdkörper funktionieren kann.